- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Соколова А.В.
1
Малишевская Н.П.
2
1 Клиника «Уральская»
2 Государственное бюджетное учреждение Свердловской области «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии»
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70%. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи у 800 пациентов, последовательно обратившихся на прием к дерматологу. В выборку включены все пациенты с новообразованиями кожи, после удаления которых было произведено гистологическое исследование материала и получено патоморфологическое заключение (n=441). Из 441 гистологического исследования новообразований кожи совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая гипердиагностики диспластических невусов и меланомы кожи. Проанализированы причины расхождения клинического и дерматоскопического с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики новообразований кожи, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних стадиях. Основными причинами гиподиагностики меланоцитарных новообразований кожи являются малый размер новообразования, визуальная однородность цвета, беспигментные или мало пигментированные новообразования, визуально и дерматоскопически определяемые ровные и четкие контуры.
меланома кожи
диспластический невус
ошибки в диагностике меланомы
гиподиагностика меланомы кожи.
1. Демидов Л.В., Харкевич Г.Ю., Маркина И.Т. Меланома и другие злокачественные новообразования кожи // Энциклопедия клинической онкологии: руководство для практических врачей. — М.: РЛС, 2005. — С. 341–364.
2. Малишевская Н.П., Игликов В.А. и др. Эпидемиология злокачественных новообразований кожи на Среднем Урале / Кунгуров Н.В. (ред.) // Злокачественные новообразования кожи: заболеваемость, ошибки диагностики, организация раннего выявления, профилактика. — Курган: Зауралье, 2010. – С. 8-33.
3. Чиссов В.И., Старинский В.В., Петрова Г.В. Качественные новообразования в России в 2011 году (заболеваемость и смертность). — М.: ФП «МНИОИ им. П.А. Герцена» Минздрава России, 2013. — 289 с.
4. Chen S.T., Geller A.C., Tsao H. Update on the epidemiology of melanoma // Curr. Dermatol. Rep. — 2013. — № 2 (1). — Р. 24–34.
5. Малишевская Н.П., Кохан М.М., Соколова А.В и др. Дерматоонкология (злокачественные новообразования кожи, первичные лимфомы кожи): атлас / под общ. ред. проф. Н.В. Кунгурова. – Екатеринбург: Изд-во Урал. ун-та, 2016. – 68 с.
6. Состояние онкологической помощи населению России в 2016 году / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. — М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. — 236 с.
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70% [1-4]. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. О значительном количестве диагностических ошибок на разных уровнях оказания медицинской помощи пациентам свидетельствует сохраняющийся высокий удельный вес больных с МК, выявленной на поздних стадиях опухолевого процесса [5]. За период с 2006 по 2016 год в РФ показатели запущенности по меланоме кожи значительно снизились (-40,6%), однако они по-прежнему остаются на недопустимо высоком уровне (18,9%) для опухолей визуальных локализаций [6]. Следует отметить, что гипердиагностика МК не влечет столь трагических последствий, как гиподиагностика, которая всегда связана с ухудшением прогноза течения заболевания и риском для жизни больного.
Цель исследования — установить причины расхождения результатов клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи (НОК) у 800 пациентов, последовательно обратившихся на прием к дерматологу. Из них в 441 (42,8%) случае выполнено удаление НОК радиоволновым или хирургическим методом с последующим гистологическим исследованием. Показаниями для удаления новообразований кожи явились подозрение на МК и диспластические невусы, все случаи сложной дифференциальной диагностики, а также все меланоцитарные новообразования, находящиеся в местах постоянного травмирования или имеющие большие размеры (>6 мм). В случаях подозрения на МК пациенты направлялись в Государственное бюджетное учреждение Свердловской области «Свердловский областной онкологический диспансер» для хирургического иссечения НОК и последующего лечения. В выборку включены все пациенты с верифицированными диагнозами НОК, в том числе пациенты с меланомой кожи на ранних (I-II) стадиях и диспластическими невусами, когда правильная и своевременная диагностика наиболее важна для дальнейшего прогноза течения заболевания (табл. 1).
Таблица 1
Структура новообразований кожи (n=441)
|
Меланоцитарные новообразования кожи |
Число больных с правильно установленным диагнозом, абс. (%) |
|
|
визуальный осмотр с использованием дерматоскопии |
гистологическое заключение |
|
|
Доброкачественные НОК |
349 (79,1%) |
361 (81,9%) |
|
Диспластические невусы кожи |
82 (18,6%) |
67 (15,2%) |
|
Меланома кожи на ранних стадиях |
10 (2,3%) |
13 (2,9%) |
Группу доброкачественных новообразований кожи составили меланоцитарные невусы без признаков дисплазии (n=263), себорейный кератоз (n=74) и гемангиомы кожи (n=12) в случаях их травмирования, с наличием геморрагических корочек на поверхности новообразований, затрудняющих визуальную и дерматоскопическую диагностику.
Таким образом, в данной выборке достоверных различий в правильности постановки диагноза при клиническом осмотре дерматолога с применением рутинной дерматоскопии и результатом гистологии не выявлено (табл. 1).
Из 441 гистологического исследования НОК совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Совпадение клинического дерматоскопического и гистологического диагнозов (n=355) выявлено в случаях доброкачественных новообразований кожи (n=305), диспластических невусов (n=45) и меланомы кожи (n=6). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая их гипердиагностики.
Проанализированы причины расхождения клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних (I-II) стадиях (табл. 2).
Таблица 2
Визуальные признаки НОК, влияющие на гиподиагностику диспластических невусов и МК с использованием дерматоскопии (n=24)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Малый размер новообразования (<6 мм) |
17 |
70,8 |
|
2. Визуально и дерматоскопически определяемые ровные четкие контуры |
3 |
12,5 |
|
3. Клинически и дерматоскопически определяемая однородность цвета |
6 |
25,0 |
|
4. Беспигментные или мало пигментированные новообразования |
5 |
20,8 |
Примечание: у одного больного могло быть несколько причин гиподиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
B соответствии с приведенными данными основными причинами гиподиагностики пигментированных новообразований кожи являются малый размер новообразования (70,8%, рис. 1), визуальная однородность цвета (25,0%, рис. 2), беспигментные или мало пигментированные новообразования (20,8%, рис. 3), визуально и дерматоскопически определяемые ровные и четкие контуры (12,5%, рис. 4).
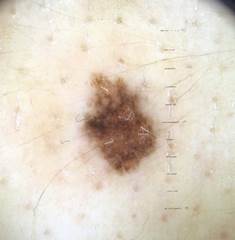
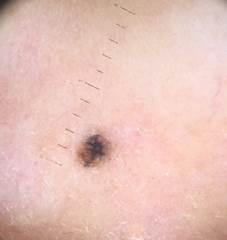
Рис. 1. Линейный размер меланомы кожи меньше 6 мм (дерматоскопическое изображение)
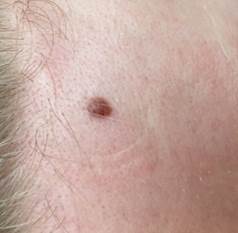
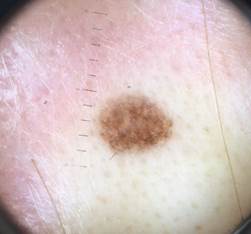
Рис. 2. Клиническое и дерматоскопическое изображение диспластического невуса кожи лба: клинически определяется визуальная однородность цвета
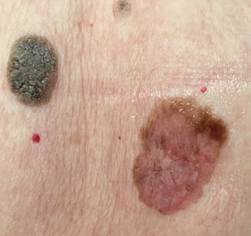
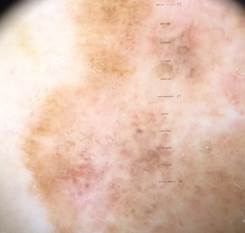
Рис. 3. Клиническое и дерматоскопическое изображение мало пигментированной меланомы кожи живота с участками регресса, выше – себорейный кератоз
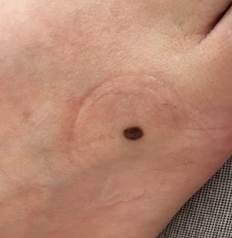
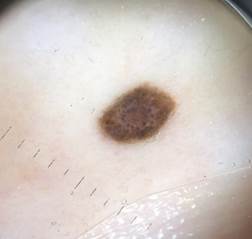
Рис. 4. Клиническое и дерматоскопическое изображение меланомы кожи тыльной поверхности стопы
Проанализированы причины гипердиагностики меланоцитарных новообразований кожи в случаях, когда возникают трудности в дифференциальной диагностике диспластических невусов и меланомы кожи (табл. 3).
Таблица 3
Визуальные признаки НОК, влияющие на гипердиагностику диспластических невусов и МК с дерматоскопией (n=34)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Большой (свыше 10 мм) размер новообразования |
13 |
54,2 |
|
2. Клинически и дерматоскопически определяемые неровные контуры и асимметричность новообразования |
9 |
37,5 |
|
3. клинически и дерматоскопически определяемая неоднородность цвета |
15 |
62,5 |
|
4. Наличие в новообразовании фрагментов темно-коричневого и черного цвета при дерматоскопии новообразований |
8 |
33,3 |
Примечание: у одного больного могли быть несколько причин гипердиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
B соответствии с данными таблицы 3 основными причинами, которые приводят к гипердиагностике диспластических невусов и меланомы кожи, являются неоднородность цвета (62,5%, рис. 5, 7), размер новообразований более 10 мм (54,2%, рис. 6), неровные контуры и асимметричность новообразования (37,5%, рис. 5), а также наличие в новообразовании фрагментов темно-коричневого и черного цвета (33,3%, рис. 5-7).
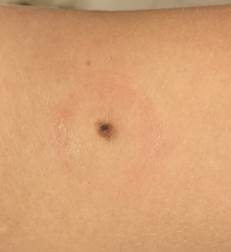
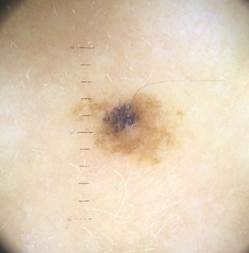
Рис. 5. Клиническое и дерматоскопическое изображение диспластического невуса кожи плеча: неоднородность цвета, неровные контуры и асимметричность новообразования, наличие в новообразовании эксцентрично расположенных фрагментов темно-коричневого и черного цвета
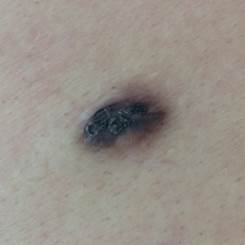
Рис. 6. Пигментированная дерматофиброма кожи бедра
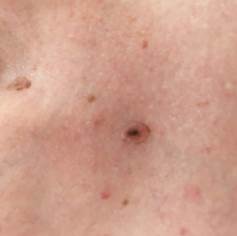
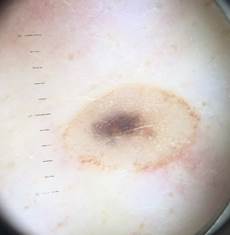
Рис. 7. Клиническое и дерматоскопическое изображение диспластического невуса кожи живота
Результаты расчета показателей диагностической точности, чувствительности и специфичности клинического осмотра с применением дерматоскопии для диагностики НОК продемонстрировали, что чувствительность клинического осмотра с применением дерматоскопии для доброкачественных новообразований кожи (91,2%) на 45,0% выше, чем чувствительность диагностики меланомы кожи (46,2%). Но при этом определяется высокая (99,1%) специфичность клинической и дерматоскопической диагностики меланомы кожи, что свидетельствует о большой вероятности совпадения диагноза с данными патоморфологического исследования. Точность диагностики меланомы кожи составляет 97,5%, что на 9,1% выше, чем точность диагностики доброкачественных новообразований кожи (88,4%) с применением метода дерматоскопии.
На следующем этапе исследования был разработан «показатель гиподиагностики», т.е. число больных, которым необходимо провести клиническое и дерматоскопическое исследование новообразований кожи для того, чтобы у одного из них установленный клинический диагноз не подтвердился результатом гистологического исследования. Показатель гиподиагностики рассчитывали как отношение неверно диагностированных случаев ко всем случаям НОК в данной группе. Этот показатель составил 18,4 в случае диспластических невусов и меланомы кожи, и 63,0 в случае только меланомы кожи. Таким образом, при осмотре 63 больных с НОК в ситуациях сложной дифференциальной диагностики дерматолог допускает один случай гиподиагностики меланомы кожи.
Диагностические ошибки за счет гиподиагностики процесса имеют наиболее неблагоприятные для течения заболевания и прогноза жизни последствия, что диктует необходимость внедрения в клиническую практику новых современных неинвазивных методов обследования меланоцитарных новообразований кожи (спектрофотометрического интрадермального анализа, конфокальной лазерной сканирующей микроскопии).
Библиографическая ссылка
Соколова А.В., Малишевская Н.П. ОШИБКИ В ДИАГНОСТИКЕ МЕЛАНОЦИТАРНЫХ НОВООБРАЗОВАНИЙ КОЖИ // Современные проблемы науки и образования. – 2018. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=27502 (дата обращения: 25.06.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
ряда цитокинов являются участниками сложных внутриклеточных каскадов, экспрессия которых может привести к онкогенной трансформации клеток и развитию промоции.
ОШИБКИ ПРИ ИСПОЛЬЗОВАНИИ ЛУЧЕВОЙ ДИАГНОСТИКИ У ПАЦИЕНТОВ С ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА
О. В. Могучая, И.Г. Захматов, В. В. Щедренок,
Е.И. Усанов, А.Ю. Улитин
РНИ нейрохирургический институт
им. проф. А.Л. Поленова, г. Санкт-Петербург, Россия
Е-mail авторов: igz@bk.ru
Цель исследования: уточнить критерии целесообразности, достаточности и сроков выполнения лучевых методов исследования у пациентов с нейроонкологией, и оценить качество лучевой диагностики на основании его соответствия принятым стандартам объема медицинской помощи.
Материалы и методы. Проведен анализ 231 истории болезни пациентов с опухолями головного мозга, находившихся на лечении в 7 стационарах Санкт-Петербурга в 2009 г., которым в различном объеме выполнены лучевые методы обследования. Выявлены наиболее распространенные ошибки в назначении, трактовке и своевременности выполнения современных методов лучевой диагностики.
Результаты и обсуждение. В 32% случаев пациентам была выполнена только МРТ, данные которой не позволяют в полной мере судить о плотности опухолевой ткани, степени деструкции костных структур при менингососудистой природе новообразования.
У 54% пациентов не была выполнена МРТ, обследование ограничивалось только данными СКТ, которые не дают должного представления о распространении процесса, выраженности перитуморозного отека, степени компрессии и деформации структур головного мозга, окружающих патологический процесс.
Введение контрастного вещества во время выполнения лучевых методов исследования при диагностике опухолей головного мозга отмечено лишь у 68% пациентов.
В соответствии с действующими стандартами и протоколами ведения этих больных оптимальной тактикой обследования является обязательное выполнение МРТ в Т1ВИ, Т2ВИ и FLAIR режимах в сагиттальной, фронтальной и аксиальной проекциях, с введением контрастного вещества, а также СКТ-исследование с оценкой плотностных характеристик для разных гистологических типов внутримозговых опухолей.
Ангиография, МР-ангиография либо СКТ-ангиография были выполнены только у 8% пациентов, хотя подозрение на вовлечение в процесс основных артерий, глубоких вен мозга и синусов имели место в 17% случаев, то есть более половины пациентов были оперированы без достаточной информации
о характере кровоснабжения опухоли.
В 52% анализированных историй болезни контрольные МРТ или СКТ-исследования не были назначены в динамике после выписки из стационара. Оптимальная тактика лучевого обследования в данном случае должна основываться на степени анапла-зии опухоли.
При анаплазии 1-2 степени контрольное МРТ-исследование с контрастированием целесообразно назначать через 6 мес. При анаплазии 3-4 степени МРТ с контрастированием необходимо повторять через каждые 3 месяца в течение года после выписки.
Выводы.
1. До настоящего времени не разработан единый алгоритм обследования пациентов с опухолями головного мозга перед операцией, несмотря на наличие целого ряда регламентирующих документов.
2. Для улучшения диагностики пациентам с опухолями головного мозга клинико-лучевые алгоритмы дооперационного периода должны включать обязательное выполнение МРТ с контрастированием в аксиальной, сагиттальной и фронтальной проекциях, СКТ, а также селективной ангиографии, либо МР-или СКТ-ангиографии при локализации новообразования в области основных артерий, вен мозга или венозных синусов.
ВРАЧЕБНЫЕ ОШИБКИ
ПРИ ДИАГНОСТИКЕ МЕЛАНОМЫ КОЖИ
Е.С. Никитина
Саратовский ГМУ им В.И. Разумовского, Россия E-mail авторов: kiti-ormanti@rambler.m
Выявлять меланому кожи должны, в первую очередь, врачи первого контакта. Поэтому диагностические ошибки на догоспитальном этапе влияют не только на тактику лечения, но и на прогноз.
Цель исследования: проанализировать причины ошибок в диагностике меланомы кожи на догоспитальном этапе.
Материалы и методы. Анализировались медицинские документы и анамнестические данные. Всего проведен анализ 150 больных, находившихся на лечении в клинике онкологии с 2009 по 2011 годы. Большинство пациентов (89,9%) обнаружили у себя опухоль самостоятельно. При профилактическом осмотре меланома выявлена у 10,1%.
Результаты и обсуждение.
45, 2012 Тюменский медицинский журнал
Из анамнеза выяснено, что длительно существующие пигментные образования на коже имелись у 78,7% пациентов. Из них у 28,7% они были врожденными, а у 50 % — появились в течение жизни.
При анализе установлено, что время, прошедшее от появления клинических признаков до обращения к врачу, у большинства больных — 69,6%, составляло от
1 до 12 месяцев. Поводом для обращения к врачу были: быстрое увеличение пигментного образования (у 71,3 % больных), кровотечение из очага (у 21,4% пациентов), изменение цвета пигментного образования (у 5,2% больных), появление увеличенных лимфатических узлов (у 2,1% пациентов). Длительность существования указанных выше симптомов различна. Чаще всего они развивались в течение 6 месяцев, что было отмечено 47,3% больными. Активизация за 7-12 месяцев была у 27,1% пациентов, а в срок до двух лет — у 25,6% человек. Не всегда больные обращались к врачу сразу после обнаружения активизации пигментных образований. Это сделали лишь 52,4%. Поздние сроки обращения за консультацией показывают, что население не обладало информацией о необходимости обследования у врачей. Первым пунктом обращения к врачу у всех больных была районная поликлиника. Основное число пациентов (74%) посетили дерматолога или хирурга. Врач первого контакта сразу направил к онкологу 42,7% пациентов. У остальных пациентов действия врачей не были направлены на уточнение диагноза. Часто врач самостоятельно давал рекомендации и назначал лечение без консультации с онкологом и верификации. Подобная тактика, впоследствии приведшая к тому, что все поступили в клинику с изъязвленной, распадающейся или метастатической меланомой, применена у 34,8%. Наблюдение в условиях поликлиники было рекомендовано 22,5% больным. Морфологическое исследование и консультация онколога, в этих наблюдениях, не были использованы. Таким образом, возможности своевременного выявления меланомы врачом поликлиники были упущены.
Выводы.
Анализ ошибок при диагностике меланомы показал, что причинами запущенности больных меланомой кожи являются формальное проведение массовых профилактических осмотров на раннее выявление меланомы и предмеланомных состояний, некачественная диспансеризация лиц с фоновой патологией, недооценка клинических данных, онкологическая неграмотность врачей первого контакта и населения, недостаточное и нерациональное использование эффективных диагностических методов.
НЕДОСТАТОЧНОСТЬ АНТИОКСИДАНТНОЙ СИСТЕМЫ ТКАНЕЙ КАК ВЕДУЩИЙ ПАТОГЕНЕТИЧЕСКИЙ ФАКТОР ДЕСТРУКТИВНОГО ДЕЙСТВИЯ ТЕРМИЧЕСКОЙ ТРАВМЫ
Н.В. Полутова, Н.П. Чеснокова, Н.В. Островский
Саратовский ГМУ, г. Саратов, Россия E-mail авторов: polutovanat@mail.ru
Актуальность проблемы термической травмы определяется ее высокой распространенностью среди всех возрастных групп населения. Так, термическая травма занимает второе место в общей структуре травматизма вслед за механическими повреждениями тканей.
До настоящего момента отсутствуют системате-зированные сведения о состоянии процессов липопе-роксидации при термическом поверхностном поражении кожи, их динамических сдвигах в период острого воспаления и на фоне развития репаративной регенерации.
Цель исследования: изучение состояния процессов липопероксидации и антирадикальной защиты клеток крови больных с ожоговой раной на фоне традиционной комплексной терапии в динамике развития патологии.
Материал и методы.
В работе представлены результаты комплексного клинико-лабораторного обследования 30 больных с поверхностными ожогами (ожог I, II и ША степени) в динамике патологии, находившихся на стационарном лечении в Саратовском центре термических поражений в 2007- 2011 гг. Первый забор крови для исследования производился на 1-е сутки патологии, что соответствовало развитию реактивно-
воспалительных процессов в ожоговой ране. Второй забор крови осуществлялся на 10-е сутки заболевания. В этот период времени начинался процесс эпи-телизации раны. Третий забор крови производился на 18-е сутки патологии (период выздоровления).
О развитии ситемных метаболических сдвигов при поверхностных ожогах кожи судили по степени интенсивности свободнорадикальной дестабилизации клеток крови, в частности по показателям содержания в крови промежуточных продуктов липо-пероксидации: диеновых конъюгатов (ДК) и малонового диальдегида (МДА). О состоянии антиоксидант-ной системы крови судили по показателям активности супероксиддисмутазы (СОД), каталазы, уровню витамина Е, 8И-групп, которые определялись общепринятыми спектрофотометрическими методами исследования.
Результаты исследования показали, что на 1-и и 10-е сутки с момента развития ожоговой раны отмечались интенсификация процессов липоперокси-дации и нарастание уровня промежуточных продуктов липопероксидации: МДА в эритроцитах и плазме крови, а ДК в эритроцитах — по сравнению с таковыми показателями контрольной группы. Избыточное накопление промежуточных продуктов липоперокси-дации сочеталось с недостаточностью механизмов антиоксидантной защиты клеток крови, на что указывало подавление активности СОД и каталазы эрит-
Тюменский медицинский журнал № 2, 2412
Grażyna Kamińska-Winciorek1, Waldemar Placek2
1The Center for Diagnostics and Treatment of Skin Diseases, Katowice, Poland
Head of Center: Grażyna Kamińska-Winciorek MD, PhD
2Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic,
Head of Department: Prof. Waldemar Placek MD, PhD
Postep Derm Alergol 2015; XXXII, 1: 33–39
DOI: 10.5114/pdia.2014.44029
Краткое содержание
Дерматоскопия — это метод оценки структуры эпидермиса и дермы in vivo. В настоящее время он, вероятно, является наиболее точным нехирургическим методом диагностики меланоцитарных ново- образований. Ошибки диагностики могут приводить к неоправданному удалению доброкачественных новообразований и, что хуже, могут пропустить раннюю меланому. Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из недостатка знаний и опыта в дерматоскопии. В настоящей статье обсуждаются наиболее распространенные ошибки начинающих или неопытных врачей.
КЛЮЧЕВЫЕ СЛОВА: дерматоскопия, дермоскопия, распространенные ошибки, базовые ошибки, неверный диагноз, принципы, правила.
Cancer Foundation. Mr March поддерживается наградой от the Office of Medical Research, University of Nevada School of Medicine. Ms Truong and Ms Strazzulla внесли равный вклад с Drs Kim and Grossman.
Адрес для корреспонденции
Prof. Waldemar Placek MD, PhD, Dermatology, Sexually Transmitted Diseases and Clinical Immunology Clinic, University of Varmia and Masuria, 30 Wojska Polskiego St, 10-229 Olsztyn, Poland, phone/fax: + 48 601 915 419, e-mail: w.placek@wp.pl
Знание основано не только на правде, но и на ошибке.
Карл Густав Юнг
Введение
Дерматоскопия (дерматоскопия, эпилюминесцентная микроскопия, микроскопия поверхности кожи) — это метод in vivo исследования структур эпидермиса и дермы. Это простой проверенный способ диагностики, подразумевающий обследование новообразований кожи, главным образом меланоцитарных, с 10-кратным увеличением в традиционных дерматоскопах и с 70–100-кратным — в видеодерматоскопах (1,2).
Дерматоскопы/дермоскопы используют неполяризованный свет, требующий иммерсии (ультразвуковой гель, масло или вода) или поляризованный свет, который не требует применения каких-либо иммерсионных жидкостей. Использование дерматоскопии на приеме дерматолога увеличивает время консультации, но лишь на 72 секунды (3), поэтому стоит использовать ее для оценки любых новообразований на теле обследуемого пациента во время стандартного осмотра.
Так это описывается в литературе, на практике же дерматоскопия меланоцитарных новообразований кожного покрова всего тела с подготовкой документации и описание занимает от 30 до 40 минут. Дерматоскопия должна быть основным диагностическим инструментом, используемым не только опытными дерматологами, но также для скрининга меланоцитарных новообразований различными специалистами, в том числе онкологами, хирургами и врачами общей практики (2, 4).
Дерматоскопия характеризуется 83 % чувствительностью и 69 % специфичностью при выявлении меланомы (5). В клинической практике чрезвычайно важно правильно оценивать новообразования на теле пациента, основываясь на технических аспектах и базовых знаниях дерматоскопии.
Цель
Настоящая статья представляет авторскую классификацию наиболее распространенных и вероятных ошибок дерматоскопии на основе литературы, доступной на ресурсе PubMed, и личного опыта.
Ошибки
Ошибки дерматоскопического анализа можно разделить на связанные с невозможностью провести надлежащие тесты (процедурные и технические ошибки), и те, которые вытекают из-за недостатка знаний и опыта в дерматоскопии. В Таблице 1 представлена авторская классификация возможных ошибок дерматоскопии.
Процедурные (технические) ошибки
Выбор новообразований для дерматоскопии
Наиболее распространенной ошибкой, которую допускают врачи, является дерматоскопическая оценка только отдельных новообразований — тех, на которые указал пациент, или которые врач выбрал на основе клинической оценки по принципу ABCDE, или морфологической — черные новообразования, наиболее крупные в диаметре, возвышающиеся, или те, которые расположены в местах, где они могут подвергаться травматизации (в зоне нижнего белья, в акральных областях).
Решение об иссечении подозрительных новообразований должно приниматься на основе сравнения их с другими новообразованиями. В исследовании Argenziano и соавторов (6) решение об удалении подозрительного новообразования после морфологической оценки единственного новообразования в дерматоскопии принималось в 55 % случаев, но сокращалось до 14 % после сравнительного анализа с другими новообразования.
Чтобы выбрать несколько новообразований для иссечения, рекомендуется подготовить карту тела пациента, чтобы дать хирургу подсказки. Отметить такие участки можно при помощи фотографий, снятых камерой телефона самого пациента (7). Следует также помнить об обследовании всех новообразований на теле, не только меланоцитарных, но также розовых папул, чтобы не пропустить меланому, соответствующую правилу EFG («возвышающаяся», «плотная при пальпации», «постоянно растущая») (8).
Другой ошибкой является игнорирование небольших меланоцитарных новообразований при дерматоскопической оценке. Многие врачи, основываясь на классификации по правилу ABCD, считают, что меланомой могут быть только новообразования более 5 мм в диаметре.
Согласно литературе, 11,4–38,2 % всех меланом имеют диаметр менее 6 мм (9–12). В исследовании Giorgi и соавторов (13) 34 меланомы были выявлены среди 103 меланоцитарных новообразований диаметром менее 6 мм (33 %). В исследовании Bono и соавторов (14) из 924 меланом 22 (2,4 %) были микромеланомами с диаметром менее 3 мм. Клиническое правило АBCD в диагностике меланомы диаметром менее 6 мм не срабатывает (13).
Дерматоскопия меланомы с диаметром менее 5 мм, как правило, выявляет атипичные сосуды, нерегулярную окраску, присутствие атипичных глобул или точек, нерегулярных радиальных линий и зоны регресса (15) (Рис. 1). Другой ошибкой является использование дерматоскопии с такой периодичностью, при которой не удается установить профиль меланоцитарного невуса. Кроме того, следует проводить тотальное обследование кожных покровов всего тела (TBSE) (16).
Бессмысленно обследование пациента, который не желает раздеваться из чувства стыда, избегая обследование области гениталий, ягодиц; когда пациент не соглашается обследовать конечности, например, не хочет снимать обувь или не дает осмотреть кожу под волосами, а такое поведение встречается часто.
Таблица 1. Наиболее распространенные ошибки при дерматоскопии
| Некорректная оценка отдельных новообразований в дерматоскопии: |
| Недостаток знаний, связанных с определением базовых или главных дерматоскопических паттернов или дерматоскопических структур, в том числе неспособность отличить псевдоподии от периферических глобул; поиск таких структур, как кристаллические, с использованием неполяризованного света. |
Процедурные (технические) ошибки: |
| 1. Выбор новообразований для дерматоскопии. Необходимо обследовать все новообразования на теле в зависимости от количества и расположения: |
| Обследование только отдельных меланоцитарных новообразований, указанных пациентом. Обследование отдельных меланоцитарных новообразований, отобранных врачом на основе клинической оценки по правилу ABCDE или при наличии черных очагов, крупных новообразований, выступающих или расположенных в местах, подвергающих их риску злокачественности за счет травмирования (в зоне нижнего белья, в акральных зонах). Неприменение дерматоскопии к розовым немеланоцитарным невусам. Использование дерматоскопии с периодичностью, не позволяющей установить профиль меланоцитарного невуса. Бессмысленное обследование пациентов без осмотра генитальных зон, ягодиц, межъягодичной зоны, ступней или скальпа (из чувства стыда или из-за несогласия пациентов на обследование данных зон). Недостаток знаний относительно факторов, которые могут влиять на дерматоскопический паттерн или доброкачественное меланоцитарное образование, и нецелесообразное хирургическое удаление (дерматоскопическое исследование загорелых пациентов или использующих автозагар, что может менять цвет дерматоскопического паттерна). Невозможность обследования без планирования контрольных осмотров (каждые три месяца, каждые 6 месяцев, каждые 12 месяцев, менее часто, никогда). |
| 2. Выбор метода дерматоскопии: |
| Неправильное нанесение иммерсионной жидкости во время дерматоскопического обследования с использованием неполяризованного света. Вероятность ошибочного диагноза меланомы, узловой или бессимптомной меланомы вследствие использования не поляризованного дерматоскопа; кристаллические структуры, блестящие белые полосы определяются в поляризованном свете. Невозможность дерматоскопического обследования при длинносрочном контроле отдельных новообразований — невозможность выявления новых очагов, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом in situ с небольшим диаметром. |
Все это может привести к неверной диагностике меланомы. Полнота дерматоскопического обследования должна стать частью медицинской практики. Риск пропустить злокачественное новообразование из-за невозможности проведения тотального обследования кожных покровов всего тела составляет 2,7 % (16).
В настоящее время дерматоскопия является точным методом выявления меланомы и минимизации неоправданных иссечений (так называемое количество, требующее иссечения — NNE, определяемое как отношение общего количества удаленных новообразований к количеству удаленных меланом (17, 18).
Недостаток знаний, относящихся к факторам, которые могут повлиять на дерматоскопический паттерн новообразования, согласно правилу «4 х 4 х 6» (19), может привести к неоправданному хирургическому удалению новообразования. Кроме того, дерматоскопическое обследование загорелых пациентов или тех, кто пользуется автозагаром, что может изменить цвет дерматоскопического рисунка, часто приводит к постановке ошибочного диагноза меланомы (20–22).
Чрезвычайно важно разработать стратегию дерматоскопического контроля для пациентов в зависимости от индивидуальных особенностей. Argenziano и соавторы (23) предлагают производить дерматоскопический контроль для предварительной оценки и последующее наблюдение отдельных новообразований при необходимости каждые 3 месяца вплоть до 54 месяцев (23).
Дерматоскопию следует проводить при краткосрочном мониторинге через 3 месяца (изменение характеристик меланомы наблюдается через 2–4 месяца), среднесрочном контроле с осмотром через 6 месяцев или долгосрочным — с ежегодным осмотром (особенно для медленно растущих меланом) (23).
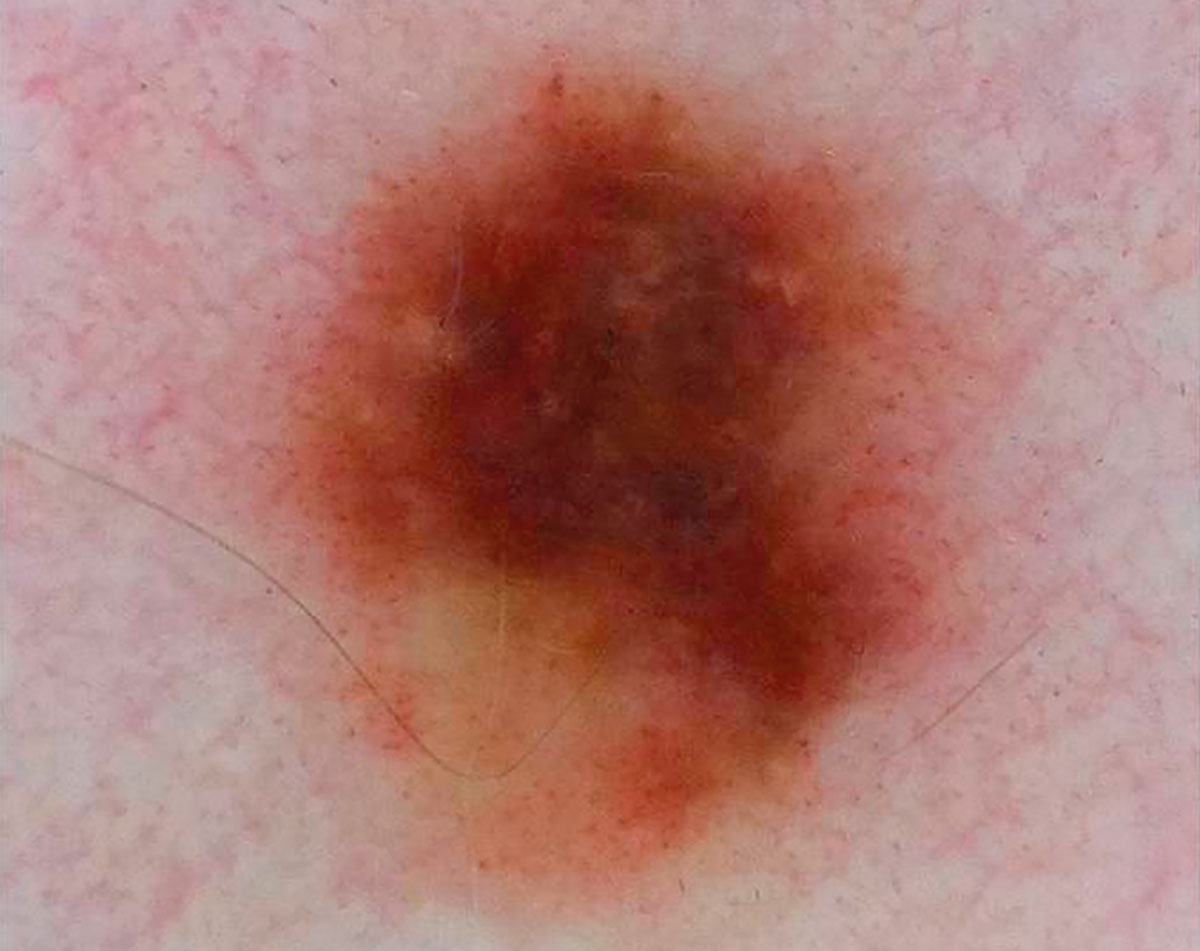
Рисунок 1. Дерматоскопический снимок меланомы in situ диаметром менее 5 мм.
Дерматоскопия показывает присутствие атипичных сосудов, атипичных глобул нерегулярного цвета, нерегулярных радиальных линий и нерегулярных многоцветных, коричневых и сине-серых участков
Степень соответствия составляет 84 % для протокола краткосрочного контроля, 64 % — для среднесрочного и 30 % — для долгосрочного (23). Периодичность контрольных осмотров зависит также от возраста пациента. Средний интервал в дерматоскопическом контроле составляет 20 месяцев (24) из-за вероятности развития медленно растущей меланомы (SGM).
Критерия для наблюдения отдельного новообразования являются асимметрия цвета, сетчатый рисунок и зоны регрессии (24). Ранние меланомы, выявленные цифровым методом, могут быть меньше в диаметре. Дерматоскопическим признаком при диагностике меланомы только лишь в контексте сравнительного исследования было небольшое увеличение диаметра очагов диаметром менее 2 мм (24).
В большом дерматоскопическом исследовании медленно растущей меланомы (25) дерматоскопическими признаками, предполагающими ее развитие, были недостаточные изменения диаметра и рост (75 % случаев) при наиболее медленном росте диаметра до 2 мм, разрушение более крупных структур, замена меланоцитарной сетки бесструктурными участками, появление новых цветовых оттенков (светло-коричневый исчезает, темно-коричневый появляется; такие цвета как красный, серый, черный и синий становятся более заметными) и новые дерматоскопические признаки меланомы, в том числе негативная сеть и сине-белая структура (25).
Выбор оптимального метода дерматоскопии
Иногда ошибка диагноза может произойти из-за небрежного использования дерматоскопии. Кроме упомянутых выше стандартных методов, для проведения дерматоскопического обследования с использованием ручного дерматоскопа важно правильно наносить иммерсионную жидкость во время дерматоскопического исследования в неполяризованном свете (2).
Вероятность ошибочного диагноза при выявлении узловой или бессимптомной меланомы может произойти из-за использования дерматоскопа с неполяризованным светом, тогда как блестящие белые полосы (кристаллы или кристаллические структуры) определяются дерматоскопами, использующими поляризованный свет (27).

Дерматоскоп Handyscope – устройство для мобильной цифровой дерматоскопии (FotoFinder)
Первое в мире устройство для цифровой теледерматоскопии, работающее на iOS и Android. В отличие от множества обычных дерматоскопов, handyscope соединяется с камерой мобильного устройства и использует специализированное программное обеспечение, включающее в себя оценку новообразований искусственным интеллектом, сервисы второго мнения и анализа клинических данных, а также сервисы защищенного облачного хранения дерматоскопических снимков.
Блестящие белые полосы указывают на злокачественность (отношение шансов: 10,534), особенно в случаях меланомы с инвазией, меланомы с высокой оценкой тотальной дерматоскопии (TDS) и тонких бессимптомных меланом (27). Кроме того, недостаточность архивных записей о предыдущих дерматоскопических обследованиях при контроле отдельных новообразований, а также невозможность определить новые очаги, неспособность оценить развитие наблюдаемых меланоцитарных новообразований, особенно медленно растущих меланом (24,25) или меланом in situ маленького диаметра, могут привести к тому, что меланома останется незамеченной.
Согласно Puig и Malvehi (28) дерматоскопическое обследование, тотальное фотографирование всего тела (TBD), цифровая дерматоскопия (DD) имеют важное значение для выявления меланомы. Цифровой контроль (DFU) у пациентов с диспластическими невусами позволяет выявить новые новообразования и изменения в существующих очагах (28).
Сочетание тотального фотографирования всего тела и цифровой дерматоскопии называется двухступенчатым методом цифрового контроля и способствует раннему выявлению меланомы на основе наблюдения макроскопических и дермоскопических изменений (29).
Ошибки, связанные с дефицитом знаний
В широком смысле ошибки, связанные с дефицитом знаний, включают диагностику и терапевтические решения, принятые в результате недостаточных знаний в области дерматоскопии. Неверный выбор новообразований для дерматоскопического обследования может быть связан с недостаточным пониманием дерматоскопического паттерна или структур, неспособностью отличить псевдоподии от периферических глобул, а также недостаток знаний различных алгоритмов дерматоскопического анализа (1, 2, 19, 30-32).
Каждый врач, выполняющий дерматоскопию, должен знать основные правила (контрольные списки): 3-точечное правило Argenziano (4, 33), 7-точечное итальянское правило (34), алгоритм, основанный на анализе паттерна («хаос и признаки») (35), австралийский метод Мензиса, 7 признаков меланомы или метод дерматоскопии Штольца и ABC-правило Блума (36), широко описанные в медицинской литературе в связи с их чувствительностью и специфичностью.
При применении правила ABCD для диагностики меланомы кожи чувствительность составляет 90,5 %, специфичность 72,4 % и диагностическая достоверность 78,1 % (36).
Результаты применения правила ABC показывают соответственно 90,5 %, 87 % и 88,1 %; метода Мензиса — 95,2 %, 77,8 %, 83,3 %; 7-признаков — 94 %, 74,6 % и 80,7 %, 7-точечного метода — 90,5 %, 87 % и 88,1 % (36). Чувствительность при использовании 3-точечного метода дерматоскопии достигает 89,6 % при 94,2 % специфичности (33).
В соответствии с 3-точечным методом следует уделить внимание асимметрии дерматоскопических правил и оценкой только лишь на основании одного из них, например, используя только правило ABCD Штольца. Поиск, например, кристаллических структур в неполяризованном свете — это не только техническая ошибка, но и ошибка, обусловленная дефицитом знаний.
Дерматоскопическая оценка отдельных немеланоцитарных новообразований должна основываться на общей структуре всего рисунка (зависит от выбранных паттернов) и локальных структурах (на основе выбранных дерматоскопических структур и признаков) и базироваться на расположении дерматоскопических структур, а не симметрии новообразования (4, 33). Также следует использовать другой нестандартный критерий — симптом «гадкого утенка» («ugly duckling» [37, 38] или симптом «fancy looking, так называемый признак «black sheep» [39]), а не только алгоритмы дерматоcкопического анализа.
Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19), позволяет клиницистам фиксировать общий паттерн и фак- торы, которые влияют на терапевтическое решение при установлении дерматоскопического диагноза отдельного меланоцитарного новообразования. Четыре дерматоскопических критерия связаны с цветом, паттерном, распределением пигмента и локализацией новообразования (19).
Шесть факторов, которые влияют на дерматоскопические действия, включают возраст, фототип кожи по Фицпатрику, историю болезни, воздействие ультрафиолета, беременность и динамику роста (19).
4 дерматоскопических критерия
| Черный | Глобульный | Многоочаговый | Акральные участки |
| Серый | Звездчатый | Необычный | Ногти |
| Коричневый | Сетчатый | Центральный | Лицо |
| Синий | Однородный синий |
Равномерный | Слизистая |
6 факторов
| Возраст | Воздействие ультрафиолета |
| Фототип кожи по Фицпатрику | Беременность |
| История болезни | Динамика роста |
Рисунок 2. Правило 4 х 4 х 6, предложенное Zalaudek и соавторами (19).
4 дерматоскопических критерия, распределенных по 4 подгруппам с 6 факторами, влияющими на терапевтическое решение, на основе дерматоскопии.
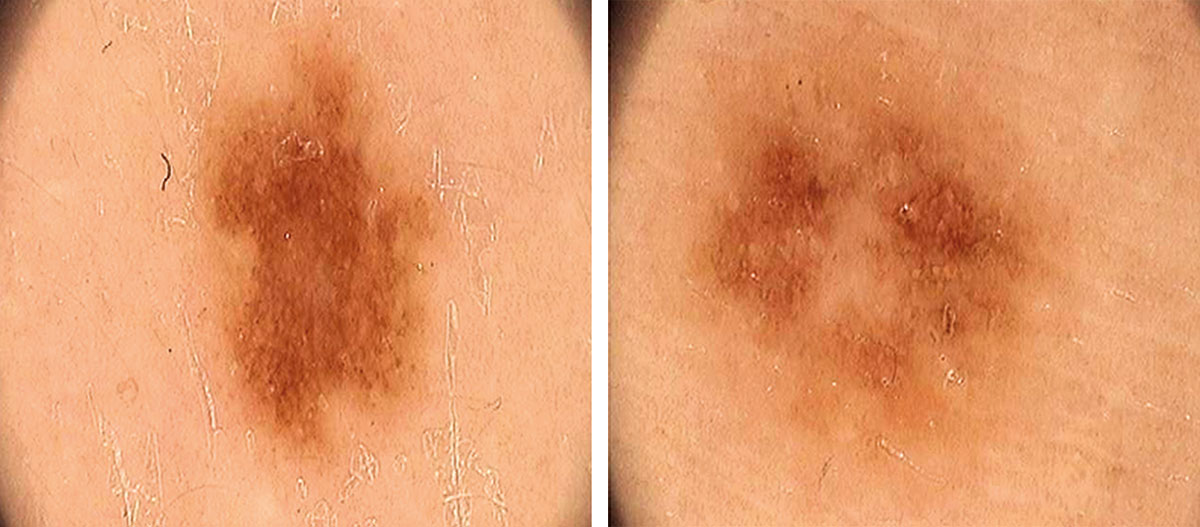
Рисунок 3. Два разных меланоцитарных новообразования у одного и того же пациента
в профиле, типичном для данного пациента
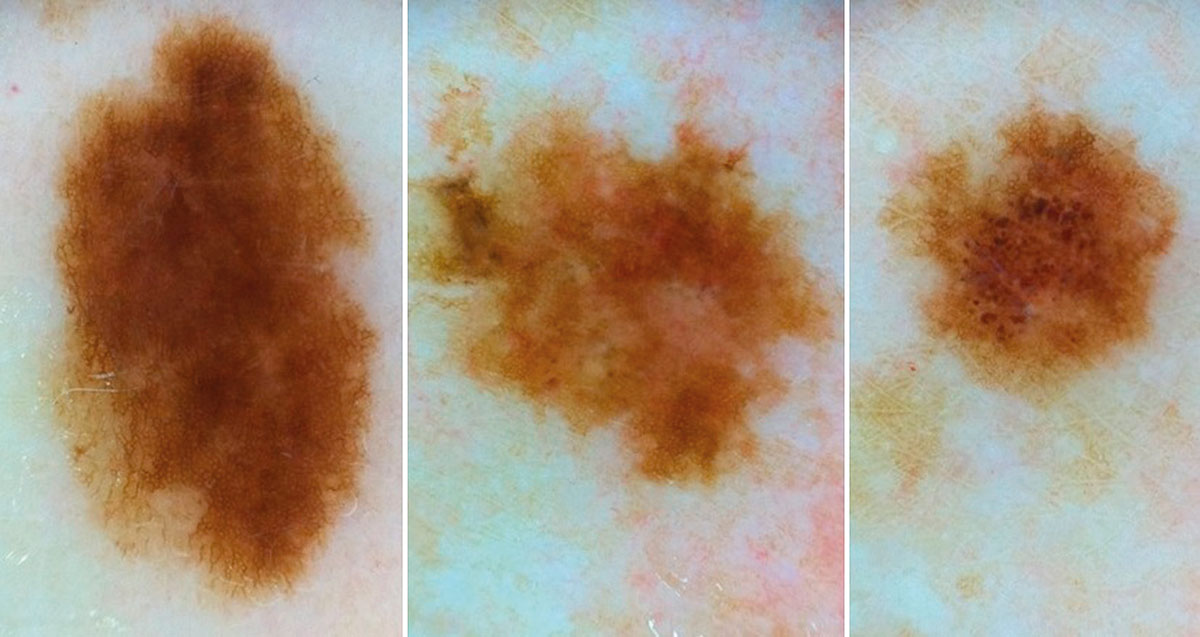
Рисунок 4. Три разных меланоцитарных новообразования у одного пациента
с дерматоскопическим профилем «подозрительное новообразование –
подлежит удалению». На деле «signature nevus», не подлежащие удалению
Правило 4 х 4 х 6, описанное ранее Zalaudek и соавторами (19), показано на Рисунке 2. В дифференциальном диагнозе меланоцитарных новообразований полезно определить так называемый профиль невуса, распространенный и характерный для большинства новообразований (6) (Рисунок 3).
Недостаточное знание критериев определения меланоцитарных новообразований и так называемых «signature nevus», характерных и индивидуальных для конкретного пациента (4) (Рисунок 4), может привести к ненужному хирургическому иссечению новообразований, которые кажутся подозрительными (например, выбор сразу 5–10 меланоцитарных новообразования для удаления во время одного обследования).
В настоящее время дерматоскопия позволяет выявлять меланому in situ диаметром менее 5 мм. В таких случаях стандартные дерматоскопические правила не работают и, следовательно, чрезвычайно важно понимать дерматоскопические признаки меланомы in situ (MIS).
Дерматоскопические признаки in situ меланом — это сетчатый рисунок, сине-серая сеть, многокомпонентная, очаговая, спитцоидная негативная сеть, сеть из глобул синего цвета и глобулярная сетчатая структура (41). Новым признаком меланомы in situ является также «mistletoe sign» (знак омелы) (42).
Меланома in situ, как правило, больше в диаметре, чем диспластический невус; атипичная сеть покрывает более половины площади, обычно присутствуют несколько типов пигментной сети, в центральной и периферийных зонах имеются бело-голубые участки регрессии (43).
В недавнем исследовании Seidenari и соавторов (44) из 22 микромеланом (диаметром менее 4 мм) 12 были определены как меланомы in situ с наиболее частым проявлением атипичной пигментной сети и нерегулярного цвета (44). В диагностике черных узелков должно применяться правило сине-черных точек.
Стандартный дерматоскопический критерий в комбинации с поиском синих и черных цветов в новообразовании дает 90,6 % точность и 92 % специфичность при выявлении узелковой меланомы (45). Предельно важным в дифференциальном дерматоскопическом анализе меланомы является понимание дерматоскопического изображения симулянтов меланомы (черного себорейного кератоза, синего невуса и многих других) (46-48).
Важно подчеркнуть, что терапевтические решения должны приниматься на основе правила 4 х 4 х 6 (19) и никогда на основе единственного дерматоскопического критерия. Что касается исследования Argenziano и соавторов (19), дерматоскопия повышает выявление ранней меланомы за счет трех главных аспектов: дерматоскопические признаки меланомы гораздо раньше выявляются при дерматоскопии, чем при клиническом обследовании; клиницисты чаще проверяют не просто подозрительные, а даже банально выглядящие новообразования и более тщательно наблюдают пациентов (49).
Полное обследование кожных покровов, наблюдение пациентов со множественными родинками, адекватная диагностика новообразований, требующих лечения; использование сравнительного подхода к пациентам с множественными невусами — это ключ к надлежащему выявлению меланомы и предотвращению базовых ошибок (49).
Таким образом, во избежание ошибочной диагностики меланомы Lallas и соавторы (5) рекомендовали обследовать все новообразования на коже, осматривать все участки тела, принимать 10-секундное решение (когда время обследования новообразования дольше, оно требует удаления), наблюдать пациентов со множественными меланоцитарными новообразованиями, всегда иссекать подозрительные узелковые новообразования и сочетать клинический критерий с дерматоскопическими, а также коррелировать клинические критерии с гистопатологическими (50).
В настоящее время дерматоскоп является незаменимым диагностическим инструментом для каждого врача, сравнимым со стетоскопом, который необходим для обследования физического состояния каждого пациента (51).
Конфликт интересов
Авторы не сообщают о конфликте интересов.
Список литературы
1. Kaminska-Winciorek G. Digital dermatology. Cornetis, Wrocław 2008.
2. Kaminska-Winciorek G, Spiewak R. Basic dermoscopy of melanocytic lesions for beginners. Postepy Hig Med Dosw (Online) 2011; 65: 501-8.
3. Zalaudek I, Kittler H, Marghoob AA, et al. Time required for a complete skin examination with and without dermoscopy: a prospective, randomized multicenter study. Arch Dermatol 2008; 144: 509-13.
4. Zalaudek I, Argenziano G, Soyer HP, et al. Dermoscopy Working Group. Three-point checklist of dermoscopy: an open internet study. Br J Dermatol 2006; 154: 431-7.
5. Blum A, Hofmann-Wellenhof R, Luedtke H, et al. Value of the clinical history for different users of dermoscopy compared with results of digital image analysis. J Eur Acad Dermatol Venereol 2004; 18: 665-9.
6. Argenziano G, Cacitrala C, Argido M. Dermoscopy of patients with multiple nevi: improvement management recommendations using a comparative diagnostic approach. Arch Dermatol 2011; 147: 46-9.
7. Kaminska-Winciorek G, Spiewak R. Tips and tricks in the dermoscopy of pigmented lesions. BMC Dermatol 2012; 12: 14.
8. Giacomel J, Zalaudek I, Mordente I, et al. Never perform laser treatment of skin tumors with clinical “EFG” criteria. J Dtsch Dermatol Ges 2008; 6: 386-8.
9. Fernandez EM, Helm KF. The diameter of melanomas. Dermatol Surg 2004; 30: 1219-22.
10. Abbasi NR, Yankowitz M, Gutkowicz-Krusin D, et al. Utility of lesion diameter in the clinical diagnosis of cutaneous melanoma. Arch Dermatol 2008; 144: 469-74.
11. Goldsmith SM. A series of melanomas smaller than 4 mm and implications for the ABCDE rule. J Eur Acad Dermatol Venereol 2007; 21: 929-34.
12. Helsing P, Loeb M. Small diameter melanoma: a follow-up of the Norwegian Melanoma Project. Br J Dermatol 2004; 151: 1081-3.
13. De Giorgi V, Savarese I, Rossari S, et al. Features of small melanocytic lesions: does small mean benign? A clinical-dermoscopic study. Melanoma Res 2012; 22: 252-6.
14. Bono A, Bartoli C, Baldi M, et al. Micro-melanoma detection. A clinical study on 22 cases of melanoma with a diameter equal to or less than 3 mm. Tumori 2004; 90: 128-31.
15. Pupelli G, Longo C, Veneziano L, et al. Small-diameter melanocytic lesions: morphological analysis by means of in vivo confocal microscopy. Br J Dermatol 2013; 168: 1027-33.
16. Argenziano G, Zalaudek I, Hofmann-Wellenhof R, et al. Total body skin examination for skin cancer screening in patients with focused symptoms. J Am Acad Dermatol 2012; 66: 212-9.
17. Argenziano G, Cerroni L, Zalaudek I, et al. Accuracy in melanoma detection: a 10-year multicenter survey. J Am Acad Dermatol 2012; 67: 54-9.
18. Chen L, Dusza S, Grazzini M, et al. Redefining the number needed to excise. Australas J Dermatol 2013; 54: 310-2.
19. Zalaudek I, Docimo G, Argenziano G. Using dermoscopic criteria and patient-related factors for the management of pigmented melanocytic nevi. Arch Dermatol 2009; 145: 816-26.
20. Orpin SD, Preston PW, Salim A. The ‘St Tropez’ sign: a new dermoscopic feature of seborrheic keratoses? Clin Exp Dermatol 2006; 31: 707-9.
21. Hofmann-Wellenhof R, Wolf P, Smolle J, et al. Influence of UVB therapy on dermoscopic features of acquired melanocytic nevi. J Am Acad Dermatol 1997; 37: 559-63.
22. Kaminska-Winciorek G. Dermatoscopy of melanocytic lesions: an influence of ultraviolet radiation. Przegl Dermatol 2008; 95: 463-7.
23. Argenziano G, Mordente, I Ferrara G. Dermoscopic monitoring of melanocytic lesions: clinical outcome and patients compliance vary according to follow-up protocols. Br J Dermatol 2008; 159: 331-6.
24. Argenziano G, Kittler H, Ferrara G, et al. Slow-growing melanoma: a dermoscopy follow-up study. Br J Dermatol 2010; 162: 267-73.
25. Terushkin V, Dusza SW, Scope A, et al. Changes observed in slow-growing melanomas during long- term dermoscopic monitoring. Br J Dermatol 2012; 166: 1213-20.
26. Jaimes N, Marghoob AA. The morphologic universe of melanoma. Dermatol Clin 2013; 31: 599-613.
27. Shitara D, Ishioka P, Alonso-Pinedo Y. Shiny white streaks: a sign of malignancy at dermoscopy of pigmented skin lesions. Acta Derm Venereol 2014; 94: 132-7.
28. Puig S, Malvehy J. Monitoring patients with multiple nevi. Dermatol Clin 2013; 31: 565-77.
29. Salerni G, Carrera C, Lovatto L, et al. Characterization of 1152 lesions excised over 10 years using total body photography and digital dermatoscopy in the surveillance of patients at high risk for melanoma. J Am Acad Dermatol 2012; 67: 836-45.
30. Soyer HP, Argenziano G, Ruocco V, et al. Dermoscopy of pigmented skin lesions. Eur J Dermatol 2001; 11: 270-6.
31. Zalaudek I, Kreusch J, Giacomel J, et al. How to diagnose nonpigmented skin tumors: a review of vascular structures seen with dermoscopy: part II. Nonmelanocytic skin tumors. J Am Acad Dermatol 2010; 63: 377-86.
32. Zalaudek I, Manzo M, Savarese I, et al. The morphologic universe of melanocytic nevi. Semin Cutan Med Surg 2009; 28:149-56.
33. Soyer HP, Argenziano G, Zalaudek I, et al. Three-point checklist of dermoscopy. A new screening method for early detection of melanoma. Dermatology 2004; 208: 27-31.
34. Argenziano G, Catricalà C, Ardigo M, et al. Seven-point checklist of dermoscopy revisited. Br J Dermatol 2011; 164: 785-90.
35. Kittler H. Dermatoscopy: introduction of a new algorithmic method based on pattern analysis for diagnosis of pigmented skin lesions. Dermatooncology: Dermatol Pract Concept 2007; 13: 1.
36. Blum A, Rassner G, Garbe C. Modified ABC-point list of dermoscopy: a simplified and highly accurate dermoscopic algorithm for the diagnosis of cutaneous melanocytic lesions. J Am Acad Dermatol 2003; 48: 672-8.
37. Carli P, Chiarugi A, de Giorgi V. Examination of lesions (including dermoscopy) without contact with the patient is associated with improper management in about 30% of equivocal melanomas. Dermatol Surg 2005; 31: 169-72.
38. Scope A, Dusza SW, Halpern AC, et al. The “ugly duckling” sign: agreement between observers. Arch Dermatol 2008; 144: 58-64.
39. Thomas L. Braun R. Atlas of dermatoscopy. Urban & Partner, Wrocław 2008.
40. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
41. Seidenari S, Bassoli S, Borsari S, et al. Variegated dermoscopy of in situ melanoma. Dermatology 2012; 224: 262-70.
42. Kaminska-Winciorek G, Właszczuk P, Wydmański J. “Mistletoe sign” probably a new dermoscopic descriptor fro melanoma in situ and melanocytic junctional nevus in the inflammatory stage. Postep Derm Alergol 2013; 30: 316-9.
43. Seidenari S, Ferrari C, Borsari S, et al. The dermoscopic variability of pigment network in melanoma in situ. Melanoma Res 2012; 22: 151-7.
44. Seidenari S, Ferrari C, Borsari S, et al. Dermoscopy of small melanomas: just miniaturized dermoscopy? Br J Dermatol 2014; 171: 1006-13.
45. Argenziano G, Longo C, Cameron A, et al. Blue-black rule: a simple dermoscopic clue to recognize pigmented nodular melanoma. Br J Dermatol 2011; 165: 1251-5.
46. Kaminska-Winciorek G, Wydmanski J. Benign simulator of melanoma on dermoscopy-black colour does not indicate always melanoma. J Preclin Clin Res 2013; 1: 6-12.
47. Kaminska-Winciorek G. Letter: “Blue pseudo-veil sign” – a new dermoscopic term? Dermatol Surg 2012; 38: 1574-5.
48. Kamińska-Winciorek G, Spiewak R. Dermoscopy on nevus comedonicus: a case report and review of the literature. Postepy Dermatol Alergol 2013; 30: 252-4.
49. Argenziano G, Albertini G, Castagnetti F, et al. Early diagnosis of melanoma: what is the impact of dermoscopy? Dermatol Ther 2012; 25: 403-9.
50. Lallas A, Zalaudek I, Apalla Z, et al. Management rules to detect melanoma. Dermatology 2013; 226: 52-60.
51. Zalaudek I, Lallas A, Moscarella E, et al. The dermatologist’s stethoscope-traditional and new applications of dermoscopy. Dermatol Pract Concept 2013; 3: 67-71.
Беспигментная меланома
Проведен систематический анализ причин позднего выявления злокачественных новообразований кожи, в том числе беспигментной меланомы, клинических и тактических ошибок врачей неонкологического профиля, анализ запущенных случаев меланомы кожи, экспертный анал
19-09-2017
Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург
Ключарева С.В.
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Новицкая Т.А.
Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург

Меланома кожи в практике врача-дерматолога
Авторы:
Жигулина А.Г., Ключарева С.В., Новицкая Т.А.
Как цитировать:
Жигулина А.Г., Ключарева С.В., Новицкая Т.А. Меланома кожи в практике врача-дерматолога. Клиническая дерматология и венерология.
2013;11(3):113‑117.
Zhigulina AG, Kliuchareva SV, Novitskaia TA. Cutaneous melanoma in a dermatologist’s practice. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(3):113‑117. (In Russ.)

Пигментные новообразования кожи встречаются в 90% случаев, из которых невусы составляют 57% [1, 2]. В связи с огромным разнообразием клинических форм, визуально поставить диагноз и исключить злокачественный характер пигментсодержащего новообразования достаточно трудно. Клиническая диагностика пигментных новообразований кожи предполагает большое количество диагностических ошибок (по данным отдельных авторов [2], до 70%). По данным Международного агентства по изучению рака (IARC) [3—7], первичная меланома кожи может развиться на фоне предшествующего меланоцитарного невуса в 28—50% случаев. Именно поэтому правильная диагностика невоклеточных невусов крайне важна для адекватного выбора лечебной тактики меланоцитарных новообразований, в том числе исключения экономного иссечения меланомы кожи (МК) под анестезией.
МК является одной из наиболее злокачественных опухолей нейроэктодермального происхождения, которая развивается из меланоцитов и меланобластов [8, 9]. Частота ее встречаемости в общей структуре заболеваемости, по данным Всемирной организации здравоохраниения [1], превышает 4%. В отличие от других злокачественных опухолей она в значительной степени поражает лиц трудоспособного возраста. По величине потери для общества в результате преждевременной смерти МК занимает одно из лидирующих мест. Так, структурно составляя не более 10% от всех форм рака кожи, 80% смертей, приходящихся на злокачественные опухоли кожи, обусловлены МК [6, 10, 11].
Проблема ранней диагностики МК остается актуальной, несмотря на поверхностную локализацию опухоли, ее хорошую визуализацию, отсутствие необходимости дорогостоящего оборудования для диагностики [12]. Ранняя диагностика МК крайне низка. При анализе распределения новых случаев МК по стадиям обращает на себя внимание высокая доля «запущенности»: почти у 1/3 больных заболевание выявлялось на этапе регионарных или отдаленных метастазов [10].
По данным НИИ онкологии им. проф. Н.Н. Петрова (Санкт-Петербург), первичная меланома выявляется на III—V уровне инвазивного роста по Clark в 94,6% случаев, в 91,6% выявляются «толстые» меланомы (более 2,0 мм по Breslow). Это свидетельствует о крайне низком уровне диагностики первичных меланом кожи. Следствием поздней диагностики являются высокие смертность и риск метастазирования, а также неблагоприятный прогноз [13].
Поздняя диагностика МК может быть обусловлена поздней обращаемостью пациентов, отсутствием настороженности врачей первичного звена и трудностями проведения макроскопической дифференциальной диагностики пигментных новообразований кожи [10, 12].
Широкая доступность центров лазерной медицины требует знания врачами-дерматологами и косметологами критериев ранней макроскопической диагностики МК.
Цель исследования — оценить критерии ранней макроскопической диагностики МК и возможность ее выявления на этапе макроскопического обследования.
Материал и методы
Обследованы 2310 пациентов с пигментными новообразованиями кожи с сентября 2010 г. по сентябрь 2012 г. на базах кафедры дерматовенерологии СЗГМУ им. И.И. Мечникова и медицинского центра «ЛазерМед».
Применяли следующие методы:
1) анкетирование, визуальный осмотр, пальпацию, фотосъемку очага поражения;
2) дерматоскопическое исследование;
3) инцизионную, эксцизионную биопсию;
4) гистологическую верификацию диагнозов.
В ходе дерматоскопического исследования для диагностики или дифференциальной диагностики МК использовали следующие критерии:
1) лентиго-меланома: специфичный признак — «классический критерий Штольца» (classical Stolz criteria), который включает:
— гиперпигментацию открытых фолликулов (hyperpigmented follicular opening): кольца (fine circle), полукольца (semi circle), удвоенные кольца (double circle), кольца неправильной формы (irregular circle);
— кольцевидно-гранулярный признак (annular-granular pattern);
— пигментированные ромбовидные структуры (pigmented rhomboidal structure);
— отсутствие волосяных фолликулов (obliterated hair follicules);
— другие признаки, характерные для данной формы: повышенная плотность сосудистой сети (vascular network), красные ромбовидные структуры (red rhomboidal structures), признак целевых узоров (target-like patterns) [14];
2) узловая меланома: преобладающие признаки — атипичные точки и глобулы (atypical dots or globules), бело-голубая вуаль (blue-white veil overaised area), бесструктурные зоны (structureless areas). Реже выявляются атипичные сосуды (atypical vessels), розовая вуаль (pink veil) [15].
Преобладание светло-коричневых и темно-коричневых оттенков, черных включений использовалось при дерматоскопической оценке МК I—II уровня инвазивного роста. При оценке более глубокого уровня инвазивного роста (III—IV) определялось присутствие в дерматоскопической картине красного, черного, серо-синего цвета [16].
Особое внимание уделялось дифференциальной диагностике невуса Сеттона, который представляет собой пигментный невус, окруженный зоной депигментации (на I—II стадии зоной гиперемии). Клинически может напоминать регрессирующую поверхностно-распространяющуюся злокачественную меланому (ПРЗМ). Дерматоскопическая картина невуса Сеттона представлена периферической депигментацией, в центре — признаки меланоцитарного, преимущественно внутридермального невуса (глобулярный, ретикулярный признак). Отсутствие меланомо-специфических признаков [17, 18].
Гистологический материал получали с помощью высокоинтенсивного углекислотного лазера или инструмента для биопсии кожи DERMO PUNCH.
Для гистологического исследования материал фиксировали в 10% нейтральном формалине, заливали в парафин, по стандартной методике окрашивали гематоксилином и эозином.
Для расчета вероятности возникновения диагностической ошибки первичного клинического обследования (показателя абсолютного риска — АР) использовали стандартную формулу: АРп=(a/a+b)·100%, где a — частота диагностической ошибки первоначального диагноза, b — частота совпадения первоначального и окончательного диагнозов.
Вероятность возникновения диагностической ошибки (АР) при дерматоскопии рассчитывали по формуле: АРд=(c/c+d)·100%, где c — частота диагностической ошибки дерматоскопии, d — частота совпадения дерматоскопического и окончательного диагнозов [19].
Пациенты с неясными диагнозами и подозрением на МК направляли на консультацию онколога и последующее диагностическое удаление, которое проводилось под наркозом в хирургическом отделении СЗГМУ им. И.И. Мечникова.
Результаты
В исследование вошли 1794 (77,66%) женщины и 71 (22,33%) мужчина в возрасте 15—87 лет (средний возраст — 37,46±0,65 года).
Результаты верификации диагнозов пигментных новообразований кожи представлены в табл 1.

Подавляющее большинство пациентов обратились с меланоцитарными новообразованиями кожи — 1680 (68,7%) человек, из них у 19 (0,8%) клинически была выявлена МК, у 123 (5,3%) — меланомоопасные невусы, к которым относятся диспластический, пограничный внутриэпидермальный невоклеточный и клеточный голубой невус. По результатам дерматоскопии МК выявлена в 26 (1,1%) случаях, меланомоопасные невусы — в 132 (5,7%).
Стандартом правильности установления клинического и дерматоскопического диагноза является патоморфологическое исследование, после которого МК была выявлена у 28 (1,2%) пациентов, меланомоопасные невусы — у 145 (6,28%).
Таким образом, имеет место гипердиагностика внутридермального невоклеточного невуса, который клинически был выявлен в 65,3% случаев, а гистологически подтвержден в 60,9% случаев. Клеточный голубой невус и невус Сеттона не имели расхождений в клиническом и гистологическом диагнозе. Расхождение между клиническим и гистологическим диагнозом пограничного внутриэпидермального невуса составило 0,5%, диспластического невуса и МК — 0,4%. Это указывает на снижение онкологической настороженности.
В дальнейшем была определена доля диагностической ошибки (рис. 1).

После дерматоскопии вероятность диагностической ошибки значительно снижается. Так, показатель абсолютного риска при диагностике немеланоцитарных образований сократился с 10 до 3,2%, внутридермальных невусов — с 6,7 до 2,6%, пограничных внутриэпидермальных невусов — с 19,7 до 12,7%, диспластических невусов — с 15 до 7,5%. Особую ценность данное исследование имеет в верификации МК. Установлено снижение вероятности диагностической ошибки с 32,1 до 7,1%. При проведении дерматоскопического исследования постановка правильного диагноза повышается на 4,1—25%.
Клинически МК была представлена следующими формами: ПРЗМ — 68,4% случаев, узловая — 21,0%, лентиго-меланома — 10,5%.
При дерматоскопическом исследовании диагностировано по одному случаю акрально-лентигинозной и персистирующей меланомы (рецидив ПРЗМ). По результатам гистологического исследования выявлено 28 случаев МК. Из них в 67,8% ПРЗМ, в 17,8% — узловая, в 14,3% — лентиго-меланома и в 3,6% — акрально-лентигинозная. Результаты скрининговых методов верификации представлены в табл. 2.

Очевидно, что достоверно установить диагноз МК клиническим методом затруднительно.
По результатам гистологического исследования было изучено распределение уровней инвазии по Clark (рис. 2).

В практике врача-дерматолога наиболее часто (в 82,1% случаев) встречается меланома I—II уровня инвазивного роста. Инвазия III уровня по Clark установлена в 14,2%, IV — в 3,5%. Пациенты с V уровнем инвазии не обращались. Полученные данные соответствуют понятию о ранней диагностике меланомы, что может привести к наиболее успешному лечению и благоприятному прогнозу.
Приводим результаты собственных наблюдений (случаи, сложные для дифференциальной диагностики).
Клиническое наблюдение 1.
Пациентка Л., 57 лет (рис. 3).

Анамнез: пигментный невус в области левого плеча существовал длительно (с юности). Субъективно не беспокоил. После травматизации вокруг появилась зона депигментации. Клиническая картина новообразования не менялась 25 лет, выставлен диагноз невус Сеттона. Год назад отмечено изменение формы и цвета пигментной части невуса (экзофитный рост центральной части).
Дерматоскопически: бело-голубая вуаль, атипичная пигментная сеть, бесструктурные зоны, атипичные сосуды.
Гистологическое исследование: узловая МК, III уровень инвазивного роста по Clark.
Клиническое наблюдение 2.
Пациентка Н., 34 года (рис. 4 и 5).


Анамнез: невус поясничной области существовал 12 лет. В последний год отмечено изменение формы, цвета и просветление (зона регрессии) в центре новообразования. На консультации у дерматолога в частном центре выставлен диагноз диспластический невус.
Дерматоскопическая картина: имеется 4—5 оттенков коричневого цвета, атипичная пигментная сеть, точки, глобулы, зона регрессии (депигментация и серо-голубые точки).
Гистологическая картина: поверхностно-распространяющаяся меланома, II уровень инвазивного роста по Clark.
Выводы
В практике врача-дерматолога МК встречается в 1,2% случаев. Преобладают (82,1%) опухоли I—II уровня инвазивного роста по Clark, что соответствует ранней диагностике МК.
Риск диагностической ошибки при постановке первичного клинического диагноза очень высок (32,1%), но значительно снижается (до 7,1%) при использовании дерматоскопического исследования, в результате чего постановка правильного диагноза повышается на 25%.
Так как врачи-дерматологи являются первичным звеном диагностики МК, необходимо, чтобы эта категория клиницистов имела четкое представление о комплексе критериев ранней диагностики злокачественной МК.
