Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
62802
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
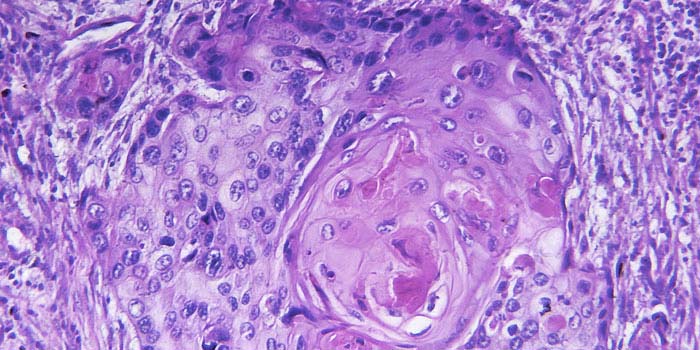
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.

Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]

Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.

Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
Не всегда результат диагностического исследования в рамках проводимой биопсии оказывается точным, бывают ошибочные. Тому виной служит как человеческий фактор, так и другие причины, например, ошибка аппаратуры.
Ошибки в гистологии
В рамках малоинвазивной хирургии образцы тканей для последующего гистологического анализа могут быть получены различными методами.
Пункционный вид биопсии предполагает забор биоматериала при помощи трубки и иглы. Не всегда необходимый для точного анализа объем биопата попадает в шприц, что сказывается на достоверности результата. В этом случае не исключен повторный забор материала.
Если нет возможности удалить опухоль полностью, производится иссечение ее части. Результат диагностики и в этом случае может быть ошибочный, так как образец, попавший на анализ, может отличаться от основной массы и объема опухоли.
Полное удаление новообразование в данном случае – это точный метод диагностики.
Ошибки в биопсии и основные причины
Основными причинами ошибки в диагностике служат следующие факторы:
● место, где производится прокол, выбрано неправильно, что приводит к поверхностному забору биопата, который не сможет продемонстрировать клиническую картину течения заболевания;
● в связи с особенностью роста новообразования, из его очага невозможно забрать необходимое для точного исследования количества материала;
● несоблюдение правил, этапов приготовления, неправильная технология исследования забранного биоматериала;
● забор произведен с нарушениями, материал в дальнейшем хранился неправильно;
● неквалифицированный специалист, производивший забор биопата.
Не меньшую роль играет квалификация медика, который в дальнейшем анализирует собранный материал и интерпретирует полученные результаты лабораторных исследований.
Что еще влияет?
Если накануне забора материала пациент принимал определенные медикаменты, это также способно повлиять на конечный результат исследования.
Конечно, ошибки при исследовании биоптата на гистологию возникают не так часто. Это случаи исключительные, с минимальным процентом риска возникновения. То же можно сказать об ошибочной трактовке результатов исследования. Такой вариант не может влиять на итог всей диагностики заболевания.
28.09.2022
Случай №28:

 Материалы 14-летнего пациента с подозрением на злокачественную опухоль яичка поступили в лабораторию ЮНИМ в Технопарке Сколково. Были проведены все необходимые гистологические и иммуногистохимические исследования, материалы были проконсультированы с помощью системы Digital Pathology© с пятью российскими и зарубежными патологами. По результатам консилиума, специалисты пришли к мнению, что у пациента наблюдается пролиферация мезотелия без признаков злокачественности (аденоматоидная опухоль или реактивная пролиферация мезотелия) — лечение и прогноз будут кардинально изменены.
Материалы 14-летнего пациента с подозрением на злокачественную опухоль яичка поступили в лабораторию ЮНИМ в Технопарке Сколково. Были проведены все необходимые гистологические и иммуногистохимические исследования, материалы были проконсультированы с помощью системы Digital Pathology© с пятью российскими и зарубежными патологами. По результатам консилиума, специалисты пришли к мнению, что у пациента наблюдается пролиферация мезотелия без признаков злокачественности (аденоматоидная опухоль или реактивная пролиферация мезотелия) — лечение и прогноз будут кардинально изменены.
Случай №27:

 Материалы 32-летней пациентки с подозрением на злокачественное новообразование нижней доли левого легкого были доставлены в новую лабораторию ЮНИМ в Технопарке Сколково. За 3 дня были проведены все необходимые гистологические и иммуногистохимические исследования, материалы были проконсультированы тремя патологами, которые коллегиально установили, что у пациентки — склерозирующая пневмоцитома, редко встречающаяся доброкачественная опухоль.
Материалы 32-летней пациентки с подозрением на злокачественное новообразование нижней доли левого легкого были доставлены в новую лабораторию ЮНИМ в Технопарке Сколково. За 3 дня были проведены все необходимые гистологические и иммуногистохимические исследования, материалы были проконсультированы тремя патологами, которые коллегиально установили, что у пациентки — склерозирующая пневмоцитома, редко встречающаяся доброкачественная опухоль.
Случай №26:
 Важным аргументом для проведения иммуногистохимических исследований является возможность предположения первичного очага опухоли в случае наличия метастазов из невыясненного очага. В данном случае поступил материал пациента с описанием «низкодифференцированная аденокарцинома без убедительных органоспецифических признаков». Иммуногистохимические исследования позволили предположить наиболее вероятный первичный очаг — молочную железу.
Важным аргументом для проведения иммуногистохимических исследований является возможность предположения первичного очага опухоли в случае наличия метастазов из невыясненного очага. В данном случае поступил материал пациента с описанием «низкодифференцированная аденокарцинома без убедительных органоспецифических признаков». Иммуногистохимические исследования позволили предположить наиболее вероятный первичный очаг — молочную железу.
Случай №25:
 В сложных случаях диагностики даже опытный врач может испытывать затруднения с постановкой точного диагноза. Тогда патологи обращаются к коллегам, специализирующимся на определенных видах опухоли, например, к дерматопатологам, как в случае этого пациента. Раньше материал было необходимо физически доставить на стол к другому врачу. Сейчас эта проблема решается быстро и просто — консультации с другими патологами можно провести через систему Digital Pathology. У пациента было подозрение на злокачественный процесс кожи. По итогам консультирования предположение о злокачественном процессе не подтвердилось.
В сложных случаях диагностики даже опытный врач может испытывать затруднения с постановкой точного диагноза. Тогда патологи обращаются к коллегам, специализирующимся на определенных видах опухоли, например, к дерматопатологам, как в случае этого пациента. Раньше материал было необходимо физически доставить на стол к другому врачу. Сейчас эта проблема решается быстро и просто — консультации с другими патологами можно провести через систему Digital Pathology. У пациента было подозрение на злокачественный процесс кожи. По итогам консультирования предположение о злокачественном процессе не подтвердилось.
Случай №24:
 С помощью иммуногистохимии становится возможным отличить очень близкие по виду состояния, злокачественные и доброкачественные. Качество исследования в таких случаях играет не последнюю роль. К нам обратился врач для уточнения результатов иммуногистохимического исследования. По результатам иммуногистохимии у врача были подозрения на 2 диагноза: фолликулярная лимфома (злокачественный процесс) или хронический лимфаденит с фолликулярной гиперплазией (доброкачественный процесс). Нашими специалистами были проведены дополнительные окраски, которые позволили поставить точный диагноз. У пациента была определена реактивная фолликулярная гиперплазия лимфатического узла, это доброкачественный процесс.
С помощью иммуногистохимии становится возможным отличить очень близкие по виду состояния, злокачественные и доброкачественные. Качество исследования в таких случаях играет не последнюю роль. К нам обратился врач для уточнения результатов иммуногистохимического исследования. По результатам иммуногистохимии у врача были подозрения на 2 диагноза: фолликулярная лимфома (злокачественный процесс) или хронический лимфаденит с фолликулярной гиперплазией (доброкачественный процесс). Нашими специалистами были проведены дополнительные окраски, которые позволили поставить точный диагноз. У пациента была определена реактивная фолликулярная гиперплазия лимфатического узла, это доброкачественный процесс.
 Случай №23:
Случай №23:
При подозрении на лимфопролиферативное заболевание гистологическое исследование должно дополняться иммуногистохимическим. Довольно часто диагноз, предполагаемый по результатам гистологического исследования, корректируется по итогам иммуногистохимии! Этот случай не стал исключением. К нам поступил материал с входящим диагнозом ангиоиммунобластная лимфома. Проведенные иммуногистохимические исследования привели к корректировке диагноза на доброкачественный — у пациента диагностирована болезнь Кастлемана.
 Случай №22:
Случай №22:
Материал следующего пациента пришел к нам на исследование из Казахстана. Входящий диагноз — неходжкинская лимфома (нодальная B-клеточная лимфома маргинальной зоны). Для качественной постановки диагноза при подозрении на лимфопролиферативное заболевание требуется иммуногистохимическое исследование! Данный случай показателен, так как по результатам иммуногистохимии онкологический диагноз не подтвердился. Пациенту был поставлен диагноз — реактивная фолликулярная гиперплазия лимфоидной ткани.
 Случай №21:
Случай №21:
Входящий гистологический диагноз — эпителиоидно-клеточная малопигментная меланома без изъязвления. После проведения пересмотра гистологии диагноз был изменен на эпителиоидноклеточный невус Шпитц. Этот тип доброкачественных образований часто вызывает сложности при дифференцировании его с меланомой ранней стадии, поэтому очень важно в этом случае проводить пересмотр гистологических стекол у патоморфолога, специализирующегося в данной области. Так как это доброкачественное образование, удаленное радикально, то пациенту не потребуется дополнительное лечение.
Случай №20:
Этот случай иллюстрирует необходимость проведения пересмотров гистологических стекол при первоначальной постановке злокачественного диагноза. К нам на исследование поступили материалы девушки 1987 г.р. с диагнозом рак яичника. По результатам пересмотра материалов нашими специалистами было вынесено другое заключение — серозная пограничная опухоль. Пациентке потребуется иное лечение, чем в случае злокачественной опухоли.
Случай №19:
Еще один случай из практики, наглядно показывающий необходимость проведения иммуногистохимических исследований для постановки точного диагноза. Материал поступил к нам со входящим диагнозом — фибромиксоидная саркома (злокачественное новообразование). Для постановки диагноза были проведены иммуногистохимические исследования. По результатам этих исследований был поставлен другой диагноз — плеоморфная фиброма (это доброкачественное образование).
Случай №18:
Этот случай иллюстрирует важность своевременного получения «второго мнения» высококвалифицированных специалистов.  Пациентке на месте были проведены гистологическое и иммуногистохимические исследования и поставлен диагноз — рак молочной железы. С этим диагнозом материалы поступили к нам. Был проведен пересмотр стекол и выполнены повторные иммуногистохимические исследования. По результатам исследований не было получено данных за неопластический (злокачественный) процесс. У пациентки фиброзно-кистозная мастопатия пролиферативной формы с фокусами склерозирующего аденоза — это не рак.
Пациентке на месте были проведены гистологическое и иммуногистохимические исследования и поставлен диагноз — рак молочной железы. С этим диагнозом материалы поступили к нам. Был проведен пересмотр стекол и выполнены повторные иммуногистохимические исследования. По результатам исследований не было получено данных за неопластический (злокачественный) процесс. У пациентки фиброзно-кистозная мастопатия пролиферативной формы с фокусами склерозирующего аденоза — это не рак.
Случай №17:
Этот случай — еще одно подтверждение необходимости проведения иммуногистохимических  исследований. К нам поступил гистологический материал с подозрением на лимфопролиферативное заболевание. Были проведены гистохимическое и иммуногистохимическое исследования — данных за неоплазию получено не было. У пациента выявлена гипоплазия гемопоэтической ткани, это доброкачественный процесс.
исследований. К нам поступил гистологический материал с подозрением на лимфопролиферативное заболевание. Были проведены гистохимическое и иммуногистохимическое исследования — данных за неоплазию получено не было. У пациента выявлена гипоплазия гемопоэтической ткани, это доброкачественный процесс.
Случай №16:
Опухоли центральной нервной системы часто представляют диагностическую сложность. Этот случай не стал исключением. Входящий диагноз — анапластическая астроцистома. В результате пересмотра гистологических стекол диагноз был скорректирован на пилоцитарную астроцистому. Этот диагноз также является злокачественным, однако стратегия лечения пациента будет существенно изменена.
Этот случай не стал исключением. Входящий диагноз — анапластическая астроцистома. В результате пересмотра гистологических стекол диагноз был скорректирован на пилоцитарную астроцистому. Этот диагноз также является злокачественным, однако стратегия лечения пациента будет существенно изменена.
Случай №15:
 Еще один случай, подтверждающий принципиальную необходимость проведения иммуногистохимических исследований при постановке онкологических диагнозов. Входящий гистологический диагноз — злокачественная фиброзная гистиоцистома большеберцовой кости. Для уточнения диагноза были проведены иммуногистохимические окраски. В результате диагноз был изменен на диффузную B-клеточную крупноклеточную лимфому. Как и в случаях, приведенных выше, гистологического исследования для точной диагностики оказалось недостаточно.
Еще один случай, подтверждающий принципиальную необходимость проведения иммуногистохимических исследований при постановке онкологических диагнозов. Входящий гистологический диагноз — злокачественная фиброзная гистиоцистома большеберцовой кости. Для уточнения диагноза были проведены иммуногистохимические окраски. В результате диагноз был изменен на диффузную B-клеточную крупноклеточную лимфому. Как и в случаях, приведенных выше, гистологического исследования для точной диагностики оказалось недостаточно.
Случай №14:
Клинический диагноз, с которым поступил материал 52-летней женщины, — B-клеточная лимфосаркома с поражением лимфоузла правой аксилярной области. Это онкологический диагноз, он требует соответствующего тяжелого лечения. Были проведены иммуногистохимические исследования, которые показали, что онкологии нет — у пациентки неспецифическая паракортикальная гиперплазия ткани лимфоузла. Этот случай в очередной раз доказывает критическую необходимость проведения иммуногистохимических исследований, в особенности для лимфопролиферативных заболеваний.
с поражением лимфоузла правой аксилярной области. Это онкологический диагноз, он требует соответствующего тяжелого лечения. Были проведены иммуногистохимические исследования, которые показали, что онкологии нет — у пациентки неспецифическая паракортикальная гиперплазия ткани лимфоузла. Этот случай в очередной раз доказывает критическую необходимость проведения иммуногистохимических исследований, в особенности для лимфопролиферативных заболеваний.
Случай №13:
Поступил материал с входящим клиническим диагнозом — нейробластома. Проведены иммуногистохимические окрашивания материала. По результатам этих исследований диагноз был изменен на B-лимфобластную лимфому, и, в соответствии с этим, пациенту потребуется кардинально другое лечение. Лимфопролиферативные заболевания часто становятся источником неверных диагнозов, так как весьма сложны в диагностике и вызывают большие затруднения при дифференцировании от других патологических процессов.
иммуногистохимические окрашивания материала. По результатам этих исследований диагноз был изменен на B-лимфобластную лимфому, и, в соответствии с этим, пациенту потребуется кардинально другое лечение. Лимфопролиферативные заболевания часто становятся источником неверных диагнозов, так как весьма сложны в диагностике и вызывают большие затруднения при дифференцировании от других патологических процессов.
Случай №12:
Входящий гистологический диагноз — анапластическая ганглиоглиома (GIII). По результатам проведенных дополнительных иммуногистохимических исследований диагноз был скорректирован на анапластическую астроцистому. Опухоли центральной нервной системы часто представляют особую сложность для точной диагностики. И несмотря на то, что оба диагноза, входящий и поставленный, означают злокачественные процессы, процедура пересмотра очень важна — пациенту скорректируют стратегию лечения на более подходящую и эффективную.
проведенных дополнительных иммуногистохимических исследований диагноз был скорректирован на анапластическую астроцистому. Опухоли центральной нервной системы часто представляют особую сложность для точной диагностики. И несмотря на то, что оба диагноза, входящий и поставленный, означают злокачественные процессы, процедура пересмотра очень важна — пациенту скорректируют стратегию лечения на более подходящую и эффективную.
Случай №11:
Поступили материалы пациента 9 лет из Новокузнецка с подозрением на миксоидную липосаркому (злокачественное новообразование). Были проведены иммуногистохимические исследования, позволившие отвергнуть онкологический диагноз. У пациента — доброкачественное образование — нейрофиброма. Случай примечателен тем, что обычно миксоидные липосаркомы развиваются из нейрофибромы, и это обуславливает сложность дифференциальной диагностики между этими двумя новообразованиями.
липосаркому (злокачественное новообразование). Были проведены иммуногистохимические исследования, позволившие отвергнуть онкологический диагноз. У пациента — доброкачественное образование — нейрофиброма. Случай примечателен тем, что обычно миксоидные липосаркомы развиваются из нейрофибромы, и это обуславливает сложность дифференциальной диагностики между этими двумя новообразованиями.
Случай №10:
Входящий клинический диагноз — рак предстательной железы. Пациент обратился за  проведением иммуногистохимического исследования, которое было осуществлено нашими специалистами в двухдневный срок. По результатам исследования онкологический диагноз был отменен, у пациента доброкачественное образование — железистая гиперплазия предстательной железы. Ошибки в гистологии для этой нозологии — не редкость.
проведением иммуногистохимического исследования, которое было осуществлено нашими специалистами в двухдневный срок. По результатам исследования онкологический диагноз был отменен, у пациента доброкачественное образование — железистая гиперплазия предстательной железы. Ошибки в гистологии для этой нозологии — не редкость.
 Случай №9:
Случай №9:
Мужчина 65 лет, Улан Удэ, входящий диагноз рак простаты, после простого пересмотра стекол нашими специалистами поставлен диагноз гиперплазия (не рак). Интересно в этом случае то, что это самый часто встречающийся вид рака у мужчин после 50.

Случай №8:
Входящий диагноз пациентки 25 лет из Иркутска — рак печени. Проведены иммуногистохимические исследования, материал оказался очень сложным в диагностике и был проконсультирован через систему Digital Pathology с профессором из Германии Дитером Хармсом, причем консультация заняла менее суток. Онкологический диагноз был изменен на доброкачественный — у пациентки аденома печени.
 Случай №7:
Случай №7:
Поступил материал с подозрением на периферический рак нижней доли правого легкого. Исследованная ткань внутрилегочного лимфатического узла содержала признаки фолликулярной гиперплазии и антракоза. По итогам консультирования опухолевое поражение не было выявлено.
Случай №6:

Материалы поступили с подозрением на мелкоклеточную лимфому. По результатам проведенных гистологических и иммуногистохимических исследований установлено отсутствие опухолевого материала. Онкологический входящий диагноз был изменен на доброкачественную гиперплазию лимфоузла, вероятно вирусного генеза. Доброкачественная гиперплазия лимфоузлов часто требует для дифференцировки с лимфомами мнения патоморфолога, специализирующегося на данном типе онкологических заболеваний.
Случай №5:
Входящий клинический диагноз — системное заболевание лимфатических узлов шеи,  подозрение на парагранулему Ходжкина. После проведенного гистологического и иммуногистохимического исследований определена реактивная фолликулярная гиперплазия ткани лимфатического узла. Лимфопролиферативные заболевания часто вызывают затруднения при диагностике, консультирование подобных случаев не редкость.
подозрение на парагранулему Ходжкина. После проведенного гистологического и иммуногистохимического исследований определена реактивная фолликулярная гиперплазия ткани лимфатического узла. Лимфопролиферативные заболевания часто вызывают затруднения при диагностике, консультирование подобных случаев не редкость.
Борисова О.В.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Ермолаева А.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Мельникова В.Ю.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Петров А.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Славнова Е.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России

Срочная интраоперационная морфологическая диагностика в онкологии
Авторы:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н.
Как цитировать:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н. Срочная интраоперационная морфологическая диагностика в онкологии. Онкология. Журнал им. П.А. Герцена.
2015;4(4):5‑11.
Volchenko NN, Borisova OV, Ermolaeva AG, Melnikova VYu, Petrov AN, Slavnova EN. Rapid intraoperative morphological diagnosis in oncology. P.A. Herzen Journal of Oncology. 2015;4(4):5‑11. (In Russ.)
https://doi.org/10.17116/onkolog2015445-11

Срочная интраоперационная морфологическая диа-гностика (СИМД) — цитологическая и гистологическая — применяется более 100 лет. В последнее время наблюдается общемировая тенденция к снижению количества срочных морфологических исследований во время операции. Это связано с широким применением минимально инвазивных методов получения материала в дооперационной диагностике с целью морфологической верификации процесса, определения факторов прогноза течения заболевания и показаний к назначению адекватной терапии. Благодаря развитию методов уточняющей морфологической диагностики, таких как иммуногистохимия (ИГХ) и цитохимия, и молекулярно-генетических методов расширяются знания об опухолях. Правильный диагноз возможен только при исследовании всего объема опухоли, включая соответствующие ИГХ и молекулярно-генетические исследования. В связи с применением методов уточняющей диагностики показания для СИМД значительно сокращаются. Однако важность срочного морфологического исследования остается несомненной. СИМД по-прежнему играет важную роль, так как определяет тактику хирурга во время операции, позволяет избежать повторных операций или излишне обширных оперативных вмешательств.
Целью интраоперационной морфологической диагностики является адекватное выполнение хирургического вмешательства. Основными задачами срочного интраоперационного морфологического исследования являются:
1) морфологическая верификация диагноза после нескольких неудачных попыток или невозможности дооперационной диагностики, а также при несоответствии морфологического диагноза операционным находкам;
2) уточнение степени распространенности опухолевого процесса путем изучения зон регионарного метастазирования, близкорасположенных органов, состояния органов высокого риска метастазирования, экссудатов и смывов из серозных оболочек;
3) установление абластичности операционных краев резекции;
4) контроль информативности взятого материала при некоторых диагностических операциях.
СИМД имеет ограниченные возможности для уточнения гистогенеза и степени дифференцировки опухоли, для определения характера опухоли (первичная или метастаз), диагностики опухолей кожи, сарком мягких тканей и костей, злокачественных лимфом, опухолевых узлов полиморфного строения, оценки степени лечебного патоморфоза. Не следует применять СИМД при подозрении на cr in situ или микроинвазию.
Показания для срочного цитологического или гистологического исследования определяет оперирующий хирург. Оба метода имеют свои преимущества и недостатки.
По данным литературы [1—6], точность СИМД в зависимости от объекта исследования составляет от 89% при исследовании лимфатических узлов до 98—99% при других локализациях. Ошибочный диагноз при СИМД возможен как ложноположительный, так и ложноотрицательный. Причинами ложноотрицательного морфологического заключения могут быть регрессия опухоли, вызванная неоадъювантной химиотерапией, некроз, замещение опухолевой ткани новообразованными сосудами, гистиоцитами, лимфоцитами и фиброзом, что может быть неправильно истолковано как хроническое воспаление. Причинами ложноположительных заключений являются резко выраженная пролиферация и реактивные изменения клеточных элементов. Эти ошибки могут быть вызваны неправильным толкованием морфологической картины, низким качеством замороженных срезов, неправильным забором материала для исследования, незнанием макроскопических признаков, сложными случаями для интерпретации, наличием только карциномы in situ в образце, гетерогенностью опухоли.
Следовательно, необходимо понимание различных проблем, с которыми может столкнуться как патологоанатом при исследовании замороженных срезов, так и цитолог при СИМД.
Для качественной интраоперационной морфологической верификации диагноза необходимо получение информативного операционного материала, правильное оформление сопроводительных документов с указанием анамнестических данных, стадии процесса, характера предоперационного лечения, сроков его проведения, макро- и микроскопического исследования операционного материала.
Цель исследования — оценить точность СИМД и проанализировать причины диагностических ошибок.
Материал и методы
В 2013 г. ФГБУ «ФМИЦ им. П.А. Герцена» выполнено 418 срочных гистологических исследований у 361 больного (7% общего количества операций) и 1198 срочных цитологических исследований у 646 (12,5%) больных. В 2014 г. выполнено 507 срочных гистологических исследований у 356 (8%) пациентов и 1356 срочных цитологических исследований у 676 (15,5%) пациентов. Для срочного гистологического исследования применяются криостатные срезы, препараты окрашиваются гематоксилином и эозином. Недостатком криостатных срезов является более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков. Срочное гистологическое исследование проводится в течение 20—30 мин. Для срочной окраски цитологических препаратов применяют набор для окраски Лейкодиф (Чехия). Срочное цитологическое исследование занимает 10—15 мин. Для исследования экссудатов из серозных полостей и диагностики метастатического поражения лимфатических узлов применяется иммунофлюоресцентное исследование (ИФИ) с антителом к эпителиальному антигену Ber-EP4 FITC («Dako»). ИФИ осуществляется на флюоресцентном микроскопе Carl Zeiss Imager M1.
Результаты
Морфологическая верификация диагноза
Интраоперационная морфологическая верификация диагноза применяется в основном при периферических образованиях легких, недоступных для дооперационного морфологического исследования, при опухолях яичников, а также при неуверенном дооперационном морфологическом диагнозе при опухолях молочной железы. Мы придерживаемся правила — не использовать срочное исследование при cr in situ, так как можно не получить категоричного заключения ни при срочном, ни при плановом исследовании.
Гистологическая СИМД для верификации процесса в легком позволила установить туберкулез в 32,8%, гамартому в 8,2%, хроническое продуктивное воспаление в 6,6% наблюдений, что дало возможность избежать излишне радикальных операций. Нейроэндокринные опухоли (типичный и атипичный карциноид) выявлены в 8,2% наблюдений (рис. 1, 2 и далее). Злокачественный процесс установлен в 44,3% наблюдений, при этом 85% составила аденокарцинома легкого, преимущественно высокодифференцированная (прежний БАР) (рис. 3), а 14,8% — метастазы аденокарциномы кишечного типа, желудка и меланомы в ткани легкого. Расхождений срочного и планового гистологического исследований не отмечалось.



При срочном цитологическом исследовании образований в легком гиподиагностика составила 6,7% (4 наблюдения из 60), что связано с получением материала из очага некроза, воспаления, а также наличием микроочагов опухоли на фоне пневмонии. В 6,6% наблюдений цитологически было дано неуверенное заключение.
Опухоли яичников всегда подвергаются СИМД с целью верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики — опухоли практически не пунктируют из-за опасности диссеминации. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 30% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т. д. (54,4%). Доброкачественные опухоли яичников диагностированы в 15,8% случаев, пограничные опухоли яичников (ПОЯ) — в 8,5%, злокачественные — в 21,5%. В одном наблюдении при СИМД диагностирована аденокарцинома яичника, а при плановом гистологическом исследовании установлена тератома. Ошибка связана с выраженной пролиферацией и образованием сосочковых структур эпителиального компонента тератомы. СИМД опухолей яичников имеет ряд ограничений, особенно при ПОЯ, которые характеризуются некоторыми гистологическими особенностями — нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией, но отсутствует стромальная инвазия. СИМД опухолей яичников определяет объем оперативного вмешательства. При доброкачественных и ПОЯ можно выполнить органосохраняющее лечение у молодых женщин, в то время как злокачественные эпителиальные опухоли, как правило, требуют обширного хирургического вмешательства с гистерэктомией, двусторонним удалением придатков матки и сальника, а также тазовой и ретроперитонеальной лимфаденэктомией. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами инструментального исследования. Желательно исследовать несколько криостатных срезов из разных участков. По нашим данным, ошибка при исследовании ПОЯ яичников имела характер гиподиагностики и составила 7%, что связано в основном с наличием лишь микроочагов опухоли (рис. 4). Большой размер опухоли, двустороннее поражение, а также муцинозный характер являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. В 20% наблюдений при исследовании брюшины при СИМД выявлены импланты ПОЯ. Если имеются инфаркт и некротические изменения, а также киста, лишенная эпителиальной выстилки, окончательные выводы следует делать при плановом гистологическом исследовании на парафиновых блоках. В 14,3% случаев при СИМД выявлены метастазы в яичниках эндометриоидной аденокарциномы, аденокарциномы шейки матки, желудка, молочной железы и почки, подтвержденные плановым гистологическим исследованием.

Таким образом, чувствительность СИМД при опухолях яичников составляет 98,7%, специфичность — 99%.
Срочное цитологическое исследование яичников применяется при пункции кист или при невозможности гистологического исследования. В одном наблюдении при исследовании кисты цитологически имелась гиподиагностика ПОЯ, что связано с объективными трудностями — клеточная атипия отсутствовала. Однако при пересмотре цитологических препаратов имелись плотные опухолевые комплексы из мелких клеток, что характерно для ПОЯ.
СИМД при образованиях молочной железы в настоящее время применяют крайне редко, так как морфологический диагноз является результатом исследования дооперационных трепанобиопсий. При расхождении цитологического и гистологического диагнозов и при неуверенном дооперационном диагнозе проводится срочное морфологическое исследование. Доброкачественные поражения составили 57%, при плановом гистологическом исследовании подтверждены такие процессы, как аденоз, фиброаденома с дисплазией эпителия. Рак молочной железы установлен в 40% (18 наблюдений), из них 33% составил дольковый рак, в 2 наблюдениях выявлена cr in situ, в одном наблюдении имелся тубулярный рак на фоне склерозирующего аденоза (рис. 5). В другом наблюдении при СИМД диагностирована липогранулема, а при плановом гистологическом исследовании выявлен небольшой очаг инвазивного рака без признаков специфичности. Чувствительность интраоперационного гистологического диагноза при раке молочной железы составляет 97%, специфичность — 100%. Неуверенное заключение дается в 1—2% наблюдений. Противопоказаниями к срочному исследованию являются внутрипротоковый и внутридольковый рак (cr in situ), внутрипротоковая папиллома. Высокодифференцированная папиллярная и тубулярная карцинома, отсутствие клеточной атипии при инвазивном дольковом раке часто при СИМД неправильно диагностируются как доброкачественные поражения как при цитологическом, так и гистологическом исследовании. Инвазивный микрососочковый рак и лимфому молочной железы трудно диагностировать при СИМД.

Случаи гипердиагностики в нашем материале не выявлены, но такие ошибки возможны при пролиферирующем папилломатозе и аденоме соска с гиперплазией эпителия протоков соска с формированием железистых и папиллярных структур, особенно с центральным некрозом, что можно ошибочно принять за внутрипротоковый рак; при склерозирующем аденозе с радиальным рубцом, когда создается впечатление инвазивного роста рака; при гранулематозном мастите, эктазии протоков и некрозе жировых клеток. Для избежания морфологической ошибки необходимо тщательное исследование препарата: отсутствие атипии эпителия, наличие миоэпителиального слоя, плотная коллагеновая строма помогают в постановке правильного морфологического диагноза.
Интраоперационно цитологически опухоли молочной железы исследуют крайне редко: при наличии кист и отсутствии дооперационного морфологического диагноза. В нашем исследовании имелось одно наблюдение, когда цитологически диагностирована папиллярная киста молочной железы, а при плановом гистологическом исследовании диагностирован папиллярный рак.
Цитологическая гиподиагностика при исследовании первичной опухоли составила 3,8%, что связано с утратой морфологических особенностей опухолевых клеток, особенно при недифференцированных и мелкоклеточных новообразованиях (например, мелкоклеточный лимфоцитоподобный рак), а также выраженными дистрофическими изменениями опухолевых клеток. Цитологическая гипердиагностика не превысила 1% и связана с выраженными реактивными изменениями эпителия.
Уточнение степени распространенности опухолевого процесса
С развитием интраоперационного ультразвукового исследования, микрохирургических пособий во время операции, позволяющих обнаружить очаги опухоли, невыявленные на дооперационном обследовании, и интраоперационных находок при непосредственной ревизии операционной раны СИМД имеет неоценимые преимущества. Проведение СИМД в 10% случаев изменяет объем оперативного вмешательства [7]. Невозможность выполнения оперативного вмешательства должна быть подтверждена морфологически.
СИМД позволяет объективно оценить состояние лимфатического коллектора. В 30—40% макроскопически неизмененных лимфатических узлов обнаруживают метастазы, а в 25—30% макроскопически похожих на метастатические узлы при микроскопическом исследовании метастазы не выявляют. Срочное интраоперационное гистологическое исследование лимфатических узлов может быть неудачным в 25% наблюдений [7]. Большое количество ложноотрицательных заключений как цитологических, так и гистологических является серьезной проблемой для клинического применения СИМД в основном из-за ограниченной способности обнаруживать микрометастазы, особенно подкапсульные, которые просто не попадают в срез или соскоб с поверхности разрезанного лимфатического узла. Кроме того, возможна потеря отдельных опухолевых клеток при приготовлении гистологического препарата. Чувствительность и специфичность срочного цитологического исследования лимфатических узлов аналогичны исследованию криостатных срезов, поэтому цитологический метод является альтернативой срочному гистологическому исследованию лимфатических узлов.
В нашем центре проведена работа по исследованию лимфатических узлов при радикальной трахелэктомии у пациенток с начальным раком шейки матки [8]. Удаленные лимфатические узлы подвергали срочному цитологическому исследованию. При обнаружении увеличенных и подозрительных по метастатическому поражению тазовых и парааортальных лимфатических узлов срочное цитологическое исследование дополняли или заменяли срочным гистологическим исследованием. По результатам срочного цитологического и гистологического исследования у 5 (6%) пациенток из 81 выявлены метастазы в лимфатических узлах, в связи с чем произведена конверсия трахелэктомии в расширенную экстирпацию матки с удалением или транспозицией придатков. Метастатическое поражение лимфатических узлов во всех случаях было подтверждено при плановом гистологическом исследовании. В 3 случаях установлены микрометастазы (<2 мм), в 2 — макрометастазы. Число положительных лимфатических узлов варьировало от 1 до 5. Во всех наблюдениях отмечались метастазы плоскоклеточного рака [8].
В настоящее время широко применяется СИМД сторожевого (сигнального) лимфатического узла (СЛУ). Метастатическое поражение СЛУ является одним из основных прогностических и предиктивных факторов при раннем раке желудка, шейки матки, молочной железы и меланоме. СЛУ является первым лимфатическим узлом на пути оттока лимфы от первичной опухоли. Отрицательный СЛУ может исключать возможность метастазов в других лимфатических узлах, что не всегда подтверждается на практике. Например, у женщин с ранним раком шейки матки и молочной железы, которые хотят сохранить репродуктивный потенциал, можно избежать радикального хирургического вмешательства, если в сторожевом узле отсутствует метастаз. Исследование СЛУ проведено гистологически у 4 пациенток при раке шейки матки, метастазов не выявлено; цитологически исследовано 3 СЛУ при раке желудка (у 2) и молочной железы (у 1), метастазов не выявлено.
Причинами гиподиагностики является исследование не всех удаленных лимфатических узлов. Оптимально исследуют не более 5 лимфатических узлов из-за ограничения временны́х рамок. Пролиферация гистиоцитарных элементов при синус-гистиоцитозе с наличием крупных полиморфных гистиоцитов может служить причиной гипердиагностики. Для уточнения диагноза используется ИФИ лимфатических узлов, повышающее достоверность цитологической диагностики до 94%.
Часто для уточнения степени распространенности опухолевого процесса исследуются близкорасположенные органы, брюшина.
Важное значение в оценке степени распространенности опухолевого процесса имеет исследование экссудатов из серозных полостей. Остается сложной и нерешенной задачей цитологического исследования диссеминатов с брюшины при перстневидно-клеточном раке желудка из мелких клеток, ПОЯ, так как эти опухоли при микроскопическом исследовании крайне сложно дифференцировать с реактивным мезотелием. Срочное гистологическое исследование в большинстве наблюдений позволяет установить диссеминацию опухоли. Применение ИФИ повышает выявляемость клеток аденогенного рака до 98% (рис. 6, 7). Из исследованных 150 экссудатов при СИМД ИФИ проведено в 17 (11%) наблюдениях, из них наиболее часто при перстневидно-клеточном раке желудка (12 наблюдений) и ПОЯ (4 наблюдения), что позволило установить диссеминацию опухоли в брюшной полости.


Достоверность СИМД метастазов в печени составляет 98%, гиподиагностика отмечена в одном наблюдении из-за резко выраженной деформации материала. Наиболее часто метастазы в печени выявляют при аденокарциноме желудка и толстой кишки.
Установление абластичности операционного края резекции
Для морфологического контроля абластичности хирургического края интраоперационное исследование имеет важное значение, так как связано с расширением показаний для экономных резекций, особенно при раке молочной железы при трахелэктомии и микрохирургических операциях на органах головы и шеи, а также при раке желудка, толстой кишки, легкого и др.
В настоящее время имеется четкая тенденция к уменьшению расстояния между опухолью и краем резекции. В последние годы появились исследования, показывающие, что сокращения края резекции не приводит к увеличению частоты местных рецидивов и ухудшению выживаемости. По мнению многих исследователей, применение лучевой терапии расширяет возможности оперативного вмешательства.
При раке молочной железы патоморфолог, как правило, дает заключение о негативном крае при расположении опухоли от 1 до 5 мм от края резекции; о позитивном крае, если опухолевые клетки присутствуют в исследуемом материале, и о сомнительном или закрытом крае, когда опухолевые клетки располагаются на расстоянии менее 1 мм от края резекции. При раке молочной железы для срочного гистологического исследования доставляется удаленная опухоль и исследуется один или два края ближайших к опухолевому узлу. Из 87 исследованных краев резекции опухоль обнаружена в 12 (13,8%). В 3 (4%) наблюдениях положительный край резекции установлен только при плановом гистологическом исследовании, что потребовало повторной операции. Факторами, определяющими гистологическую гиподиагностику при СИМД, являются обширный внутрипротоковый компонент и инвазивная дольковая карцинома.
При раке молочной железы проводят срочное цитологическое исследование нижнего и верхнего краев резекции, подсосковой зоны, иногда исследуют медиальный и латеральный края. У 2,5% больных в крае резекции обнаружены опухолевые клетки. Ложноотрицательные цитологические заключения составили 1,2%.
Для исследования краев резекции при раке молочной железы часто доставляется жир, а паренхима молочной железы отсутствует, поэтому адекватно оценить абластичность не представляется возможным.
Оценка края резекции при раке желудка рекомендуется для пациентов при T3 или T4 стадии заболевания, интраоперационно исследуют, как правило, проксимальный край резекции. Срочное гистологическое исследование позволило выявить опухолевый рост в крае резекции при раке желудка в 8% наблюдений. Положительный край был обусловлен инвазией опухоли подслизистого слоя, неопределяемой при макроскопическом исследовании (рис. 8).

При резекции легкого гистологическое исследование краев резекции применяется редко, за 2 года всего 11 наблюдений. Опухолевые клетки обнаружены только в одном наблюдении при неходжкинской лимфоме. Цитологически край резекции бронха исследовали в 17 наблюдениях, опухолевые клетки не обнаружены.
При раке пищевода опухолевые клетки по краю резекции обнаружены в 11,5%, в одном наблюдении опухоль по краю резекции выявлена только при плановом гистологическом исследовании.
Для оценки адекватности удаления шейки матки при трахелэктомии, выполняли поперечный срез толщиной 1—2 мм с ее резидуальной части для срочного гистологического исследования. С помощью CytoBrush из сохраняемого отрезка цервикального канала получали материал с последующим проведением интраоперационного цитологического анализа. Положительная граница резекции интраоперационно установлена у 5 (6%) из 81 больной. В одном случае, по данным срочного гистологического исследования, выявили рак in situ по краю резекции, в связи с чем произвели дополнительное дисковидное иссечение шейки матки, что позволило обеспечить отрицательную границу резекции и выполнить органосохраняющую операцию. В остальных 4 случаях произведена конверсия трахелэктомии в расширенную экстирпацию матки с транспозицией яичников. Положительная граница резекции в 2 случаях из 5 обнаружена при аденокарциноме, в 2 случаях при аденоплоскоклеточном раке и лишь в одном случае при плоскоклеточном гистотипе [8].
Исследование краев резекции при раке поджелудочной железы проведено в 6 наблюдениях, из них в 3 гистологически выявлена аденокарцинома.
В нашем центре широко применяется цитологическое исследование краев резекции при операциях на органах головы и шеи — опухолевые клетки выявлены в 6,8% наблюдений.
С целью определения абластичности краев резекции при онкоортопедических операциях исследование костного мозга на криостатных срезах практически не применяется, поэтому используется срочное цитологическое исследование. Достоверность исследования составляет 98,8%.
В целом 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства, чтобы сделать его адекватным.
Контроль информативности взятого материала при некоторых диагностических операциях
При опухолях мягких тканей и костей, средостения диагноз возможен только при комплексном клинико-морфологическом исследовании с обязательным применением методов иммуногистохимии, а также во многих случаях молекулярно-генетических методов исследования. Интраоперационная морфологическая, в основном цитологическая диагностика применяется с целью контроля информативности взятого материала для планового гистологического исследования и по информативности не уступает исследованию замороженных срезов. По данным некоторых авторов, диагноз был бы невозможен без цитологического исследования. Это, как правило, лимфома, плазмоцитома, саркома Юинга, метастатическая карцинома, метастатическая меланома, рак из клеток Меркеля, липосаркома. Для малоклеточных, фиброзных, миксоидных и опухолей из жировой ткани роль цитологического исследования отпечатков ограничена.
Заключение
СИМД остается незаменимой в онкологии, так как способна уточнить информацию о характере патологического процесса, степени его распространения, состояния окружающих тканей и краев резекции, что необходимо при выборе адекватного хирургического вмешательства. Однако, при неясном диагнозе и при небольшом количестве полученного материала не следует любой ценой добиваться интраоперационного морфологического исследования, особенно если речь идет о редких опухолях и неинвазивном раке.
Чувствительность гистологического метода при СИМД составляет 98%, специфичность — 99%, чувствительность цитологического метода при СИМД составляет 95%, специфичность — 96%. Гистологическая гипердиагностика при срочном исследовании составляет 0,5%, гиподиагностика 1%, цитологическая гипердиагностика — 3%, гиподиагностика — 9%. Заключения в предположительной форме при срочном гистологическом исследовании составляют 2%, при цитологическом — 11%. В 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства. Неинформативный материал при срочном исследовании достигает 2—5%, в основном при срочном цитологическом исследовании.
Золотым стандартом морфологического исследования является комплексное цитологическое и гистологическое исследования, которые являются взаимодополняющими. Необходимо подчеркнуть значение междисциплинарного подхода к диагностике, в том числе и интраоперационной, включая клинические данные и результаты инструментальных методов исследования с целью достижения точного диагноза.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В.
Сбор и обработка материала: В.Ю.М., А.Г.Е., О.В.Б., Е.Н.С.
Статистическая обработка: О.В.Б., А.Н.П.
Написание текста: В.Н.Н., О.В.Б.
Редактирование: В.Н.Н.
Конфликт интересов отсутствует.
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
С каким образцами опухолевых клеток работает патоморфология?
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Зачем изучать опухоли под микроскопом?
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Гистология и иммуногистохимия — в чем отличие?
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Зачем нужно иммуногистохимическое исследование?
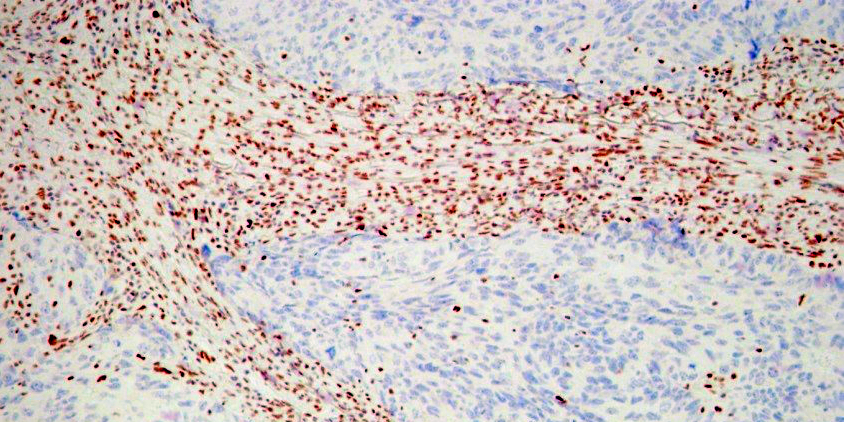
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
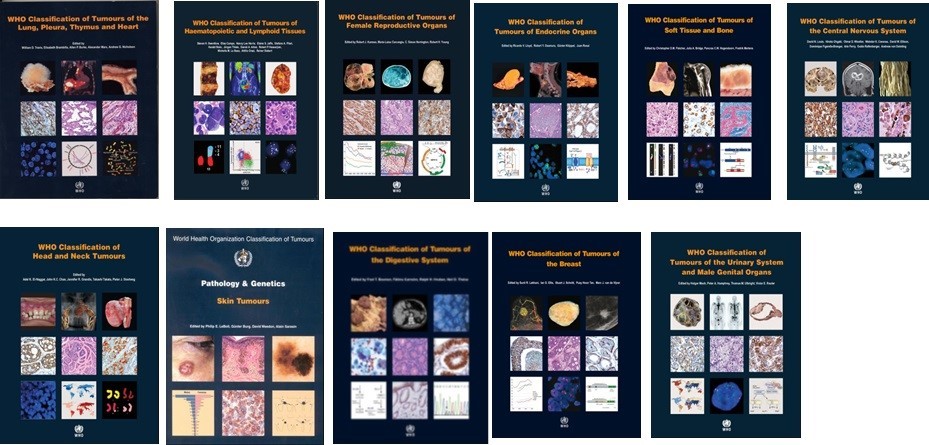
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
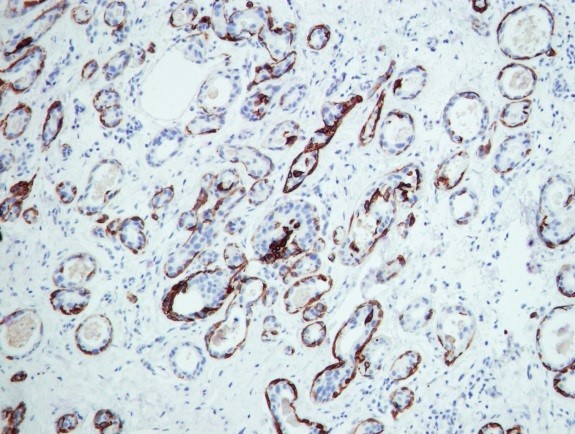
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Лечим метастазы. Когда не обойтись без патоморфолога?
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Молекулярные исследования + Таргетная терапия + Иммунотерапия = Эффективное лечение рака
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
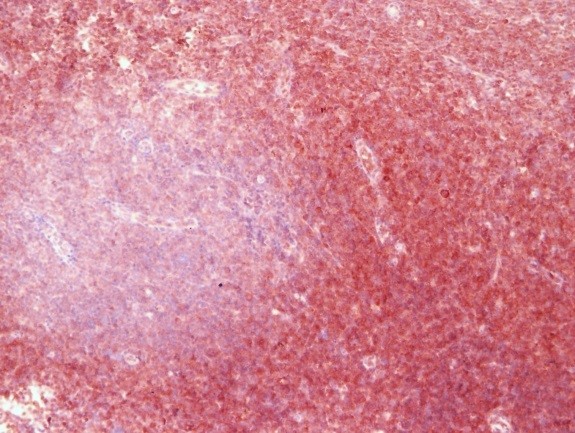
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Какой рак можно вылечить без операции?
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
- рак молочной железы;
- рак простаты;
- рак кишечника;
- рак легкого;
- лимфомы;
- рак желудка;
- меланома
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Как повысить качество морфологической диагностики в клиниках России?
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
Почему следует выбрать патоморфологическую лабораторию МИБС?
- исследование и оценка рассматриваемого материала проводится одновременно несколькими ведущими специалистами в центральной патоморфологической лаборатории МИБС в Санкт-Петербурге, сотрудничающей с федеральными онкологическими центрами.
- все вопросы логистики центр МИБС в вашем регионе берет на себя.
- МИБС владеет всеми технологиями, необходимыми для постановки правильного патоморфологического диагноза. От вас не потребуется проводить дополнительные исследования в других лабораториях.
- Иммуногистохимическое исследование может быть проведено в полном объеме за счет средств ОМС (бесплатно для пациента) при наличии направления по форме 14у.
Как заказать морфологическое / иммуногистохимическое исследование в МИБС?
- позвоните в любой центр МИБС в вашем регионе;
- привезите материал (гистологические препараты, парафиновые блоки, копию выписки из истории болезни и прочие документы, описывающие характер заболевания) в центр МИБС вашего города;
- получите заключение через 3-10 дней (в зависимости от вида и объема исследования).

заместитель главного врача по лабораторной медицине МИБС
врач-патологоанатом
доктор медицинских наук
